Genetiske masseundersøkelser (screening) er undersøkelser som gjøres på hele, eller en del, av en populasjon. Undersøkelsene tilbys for eksempel den befolkningsgruppen som har riktig alder for å starte med behandling av sykdommen, eller i en populasjon hvor det er høy sannsynlighet for å finne konkrete genvarianter som man leter etter. I Norge er Nyfødtscreeningen i dag det eneste screeningprogrammet for alvorlig medfødt (genetisk) sykdom, men i andre land tilbys screening for arvelig sykdom til andre grupper. Screening skiller seg fra analyse av sekundære funn (kapittel 6.7), som ikke tilbys i Norge, men som tilbys i enkelte andre land. Sistnevnte er et tilbud til den delen av populasjonen som allerede er genom- eller eksomsekvensert for en annen tilstand, og som det derfor er mulig å tilby undersøkelse for flere genetiske sykdomsvarianter. For begge typer undersøkelser letes det bare etter sykdomsvarianter hvor det er etablert forebygging eller behandling av den aktuelle tilstanden.
Dagens regulering
Bioteknologiloven og forskrift om genetisk masseundersøkelse av nyfødte
Bioteknologilovens § 5-6 lyder: «Kongen kan gi forskrifter om godkjenning av genetiske masseundersøkelser og farmakogenetiske undersøkelser. I forskriften kan det gjøres unntak fra lovens krav om skriftlig samtykke, genetisk veiledning, godkjenning av virksomhet eller rapportering». I 2007 ble det gitt en forskrift om genetisk masseundersøkelser av nyfødte (nyfødtscreeningen).
Formålet med forskrift om genetisk massetesting av nyfødte er å legge til rette for en faglig forsvarlig gjennomføring av genetisk masseundersøkelse av nyfødte for alvorlige medfødte/arvelige sykdommer. Formålet er også å legge til rette for overvåking og kvalitetssikring av helsehjelpen som gis for disse sykdommene.
Forskriften lister opp sykdommene som alle nyfødte skal tilbys undersøkelse for. Det spesifiseres at undersøkelsene kan gjennomføres uten hensyn til bioteknologilovens krav om skriftlig samtykke, jf. § 5-4, genetisk veiledning før, under og etter undersøkelsen, jf. § 5-5 og godkjenning av virksomheten, jf. § 7-1. Forskriften gir også bestemmelser om hvordan blodprøver skal brukes og oppbevares og hvordan helseopplysningene skal behandles m.v.
Dagens praksis
Nyfødtscreeningen
Helsedirektoratet leverte i 2024 en utredning om nyfødtscreeningen, «Forslag til endringer i prosess for inkludering av nye sykdommer i nyfødtscreeningen» til Helse- og omsorgsdeaprtementet. Vi viser til omtale av nyfødtscreeningen og behov for endringer slik det fremgår i rapporten.
Formålet med nyfødtscreening er å identifisere alvorlig, medfødt sykdom hos nyfødte. Det er viktig å oppdage sykdommene tidlig, slik at barnet kan få effektiv behandling som kan hindre alvorlig helsetap eller livstruende sykdom. Barna fødes vanligvis uten klare tegn til sykdom [280], og testing av alle nyfødte er derfor eneste mulighet til å oppdage sykdommene og iverksette nødvendige tiltak i tide.
De fleste sykdommene som inngår i screeningen oppdages ved å analysere mønstre av bestemte proteiner i en blodprøve fra den nyfødte. Unormale mønstre (metabolske funn) fra nyfødtscreeningen bekreftes med gjentatt måling og i de fleste tilfeller gjøres det også genetiske undersøkelser for å bekrefte funnet. Undersøkelsene gjøres svært raskt, slik at Nyfødtscreeningen kan melde fra om funn og behov for øyeblikkelig behandling av det nyfødte barnet innen 12-48 timer etter fødsel.
Helsedirektoratet har i sin rapport pekt på behovet for å klargjøre og vurdere om Nyfødtscreeningen kan lagre data om flere relevante biokjemiske markører enn de som i dag inngår i Nyfødtscreeningen. De aktuelle biokjemiske biomarkørene finnes i filterkortene med blodprøver, men lagring av blodprøvene i filterkort fører til at markørene degraderes over tid, og derfor ikke kan brukes på samme måte som lagrede data. Hensikten med lagring av data er å etablere normaldatasett for screeningtilstander som vil bli relevante litt frem i tid. Dette vil i stor grad klassifiseres som metodeutvikling i samsvar med formålet med biobanken, og vil også kunne være nødvendig for helsehjelp i enkelttilfeller, samt forskning.
Etter at Helsedirektoratet leverte sin rapport, er nyfødtscreeningen utvidet. Screeningprogrammet omfatter nå 30 alvorlige medfødte sykdommer og sykdomsgrupper [281]. Screeningen omfatter to endokrinologiske sykdommer, 25 metabolske sykdommer, alvorlig kombinert immunsvikt (SCID) og andre alvorlige T-celle defekter, spinal muskelatrofi (SMA) og cystisk fibrose.
Utviklingstrekk internasjonalt: Nyfødtscreening
I et tiårsperspektiv kan det bli mulig å screene for flere tilstander gjennom genomundersøkelser. Det finnes program i andre land som har innført, eller studerer nytteverdien av å screene nyfødte ved hjelp av målrettede genpaneler for alvorlige tilstander som det er mulig å behandle [282]. Genpanelene benyttes enten som en integrert del av ordinær nyfødtscreening med biokjemiske analyser eller tilbys som en separat type nyfødtscreening. For en del av de alvorlige progredierende medfødte tilstandene (tilstander som forverres over tid) finnes det ikke biomarkører utover genvariant, og genetiske analyser er derfor nødvendig for å oppdage tilstanden mens den fremdeles er i symptomfri fase [283].
Utviklingstrekk internasjonalt: screening for familiær hyperkolesterolemi
Det finnes enkelte arvelige sykdommer som kan ha store konsekvenser for pasienten og som kan behandles med god effekt, men som ikke debuterer så tidlig at de til nå har vært tatt inn i nyfødtscreeningen. Et eksempel er familiær hyperkolesterolemi, som forekommer hos ca. 1 av 200 i befolkningen.
Ved familiær hyperkolesterolemi får 93 prosent av pasientene hjertesykdom i løpet av livet, og snittalder for første hjerteinfarkt er i 40-årene. Den totale kolesterolbelastningen tidlig i livet er stor siden pasientene har høyt kolesterol fra første leveår. Å oppdage familiær hyperkolesterolemi tidlig har store helsefordeler ettersom risikoen for å utvikle hjertesykdom reduseres betydelig med tidlig behandling.
Tilstanden kan påvises ved å måle høyt LDL (eng. low density lipoproteins) i blodet hos unge personer. I godt voksen alder stiger også kolesterolet hos normalbefolkningen, og forskjellene i LDL mellom personer med familiær hyperkolesterolemi og andre er da tilsynelatende små. Imidlertid vil kolesterolbelastningen personen har vært utsatt for gjennom hele livet, gjøre personen mer utsatt for hjerteinfarkt.
Opplysninger om familiær hyperkolesterolemi er først av betydning for behandling av barnet fra 6–8 års alder. Påvisning av sykdomsgen hos barna vil være verdifullt både for å være klar over den livslange kolesterolbelastningen, og for å varsle slektninger.
Barnescreening for familiær hyperkolesterolemi ble i 2021 anerkjent av Den europeiske kommisjonens portal for beste praksis innen folkehelse som en av de beste praksisene for forebygging av ikke-smittsomme sykdommer [284]. I Nasjonal strategi for persontilpasset medisin 2023–2030 står det at
«å oppdage familiær hyperkolesterolemi tidlig har store helsefordeler da risikoen for å utvikle hjertesykdom reduseres betydelig med tidlig behandling. Familierettet screening for familiær hyperkolesterolemi anses å være modent for implementering i helsetjenesten (...)».
Verdens hjerteorganisasjon foreslår også screening for familiær hyperkolesterolemi for barn, foreldre av affiserte barn, og første- og andregradsslektninger [285]. I Europa er det Slovenia og Slovakia som er kommet lengst i implementeringen av universell screening for familiær hyperkolesterolemi, mens Tyskland, Tsjekkia, Estland og Hellas er på vei [284].
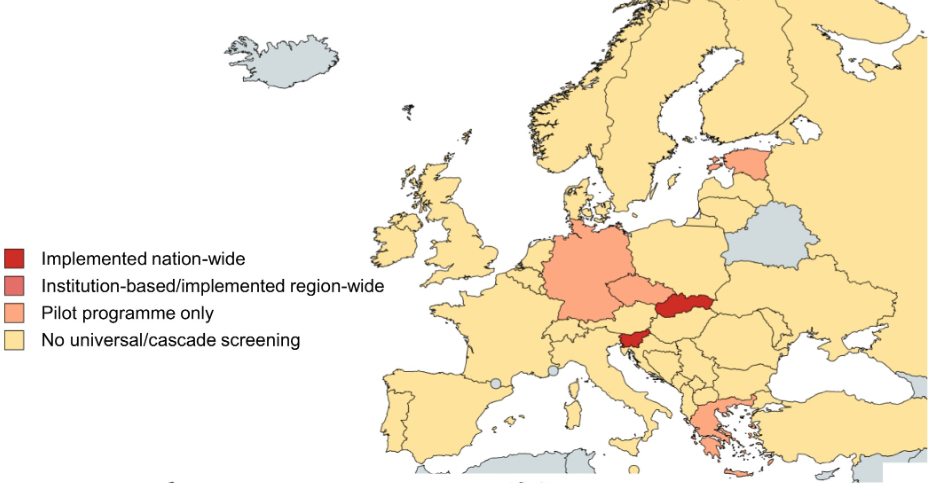
Forklaring til figuren: Land som har implementert universell screening for familiær hyperkolesterolemi. Figuren er et utsnitt fra Gidding et al. (2022) [284].
Utviklingstrekk internasjonalt: BRCA-hjemmetester i «NHS Jewish BRCA Testing Programme»
De som er født med visse mutasjoner i BRCA1- og BRCA2-genene har en økt livslang risiko for å utvikle bryst-, eggstokk-, prostata- eller bukspyttkjertelkreft. Det har vært diskutert i arbeidsgruppen om man bør forsøke å fange opp personer med disse mutasjonene før de blir syke.
Et eksempel fra utlandet er NHS' arbeid med å forebygge kreft hos personer med jødisk avstamming [286]. Personer med jødisk avstamning har langt større sannsynlighet for å ha arvet sykdomsgivende (patogene) BRCA-varianter enn den generelle befolkningen. For eksempel er 1 av 40 askenasiske jøder og omtrent 1 av 140 sefardiske jøder bærere av et defekt BRCA-gen, sammenlignet med omtrent 1 av 250 i den britiske befolkningen for øvrig.
Forskning viser også at opptil 40 prosent av tilfellene med eggstokkreft, og 10 prosent av tilfellene med brystkreft i det jødiske samfunnet er assosiert med en BRCA-genfeil.
NHS Jewish BRCA Testing Programme ble lansert i januar 2023. Programmet er en del av en omfattende innsats fra NHS for å oppdage kreft tidligere, når den er enklere å behandle, og for å bedre identifisere personer med økt risiko, for å bidra til å forhindre flere krefttilfeller og redde liv. I programmet tilbys BRCA-gentesting for alle som bor i England, er 18 år eller eldre og har minst en jødisk besteforelder. Tester kan bestilles online via NHS og utføres hjemme ved at man tar en spyttprøve som deretter sendes til et laboratorium.
Etter analyse av omtrent 11 000 tester hadde man funnet 235 personer (2,1 prosent) som testet positivt for en BRCA-genmutasjon. Personer som blir funnet å ha endrede BRCA-gener får tidlig tilgang til NHS' kreftdeteksjonstjenester, slik som mammografi eller MR-skanning, og kan også bli tilbudt forebyggende kirurgi eller medikamentell behandling, samt få råd om som reduserer risikoen [287].
Dette er et eksempel på hvordan personer i en folkegruppe med økt risiko kan tilbys testing og oppfølging. Økt forekomst av patogene BRCA-mutasjoner finnes også i andre folkegrupper.
Problemstillinger
Digitalisering av helseopplysninger i nyfødtscreening
En eventuell fremtidig bruk av genomundersøkelser i nyfødtscreeningen vil kunne innebære at genomet til de nyfødte vil være digitaliserte helseopplysninger og ikke lenger kun potensiell informasjon i lagret biologisk materiale.
I utredningen Juridiske og etiske sider ved etablering av nasjonalt genomsenter med registerløsninger har Helsedirektoratet anbefalt å utrede en rekke problemstillinger som aktualiseres når genomanalyser i forbindelse med utredning av barn blir mer vanlig. Eksempler på problemstillinger er:
- Hvilke regler skal gjelde for bruk av genomdata fra foster/nyfødte/barn i fremtiden?
- Skal foreldres samtykke til at genomdata fra barn kan brukes til kvalitetssikring og forskning gjelde etter at barnet har fylt 16 år?
- Bør det etableres en plikt til å varsle og informere personer som fyller 16 år og som er utredet ved hjelp av genomanalyser (i en eller annen form), slik at de har en reell mulighet til å bestemme om de ev. vil endre et samtykke som foreldre har gitt på deres vegne?
Nyfødtscreeningen har et system for å gi informasjon til 16-åringer om at deres biologiske materiale og data er lagret i forbindelse med nyfødtscreeningen. Det følger av loven om behandlingsbiobanker § 9a femte ledd.
Bør tilbudet om genetiske undersøkelser utvides?
Det finnes flere screeningprogrammer som kan være relevante å vurdere nærmere i arbeidet med en mulig utvidelse av tilbudet om genetiske undersøkelser i Norge. Her nevnes noen kort.
Screening av familiær hyperkolesterolemi hos barn
Nasjonalt kvalitets- og kompetansenettverk for familiær hyperkolesterolemi (tidligere Nasjonal kompetansetjeneste for familiær hyperkolesterolemi), Enhet for hjertegenetikk ved Oslo Universitetssykehus, og Pasientforeningen for familiær hyperkolesterolemi (FH Norge), har engasjert seg i behovet for screening i Norge, og har blant annet innledet et samarbeid med Nyfødtscreeningen for å arbeide videre med dette. En problemstilling som må undersøkes er hvorvidt slik genetisk screening påvirker barns framtidig muligheter til å tegne helseforsikring.
Systematisk varsling av utilsiktede funn om arvelig kreft
Friske personer som ikke selv har hatt bryst- eller eggstokkreft kan få tilbud om gentesting. Disse personene plukkes ut ved kjent genfeil i familien, eller etter nærmere definerte kriterier basert på familiehistorie som gir grunnlag for mistanke om arvelig kreft. Arbeidsgruppen har diskutert om det i tillegg er behov for å fange opp andre med potensiell risiko mer systematisk enn i dag. Det er flere innfallsvinkler:
Et moderat forslag er å sikre tilbakemelding til pasienter som utredes for genetisk sykdom når slike mutasjoner dukker opp som et utilsiktet funn. Dette omhandles under problemstillinger i kapittelet om utilsiktede funn i evalueringens del 1.
I Norge har det vært kjent at noen BRCA-mutasjoner (founder-mutasjoner) spesielt forekommer i slekter fra noen regionale områder, og det har vært ulike initiativer for å fange opp disse slektene. I dag er man også kjent med nyere mutasjoner. En mulighet er å reanalysere gamle prøver for å finne pasienter hvor det kan være aktuelt å gjennomføre kaskadetesting i familien [288].
En klinisk behandlingsstudie i Norge [289] tester nå ut bruk av polygen risikoscore utviklet i Estland til friske kvinner, for forskning på risikobasert, persontilpasset tilbud om mammografiscreening.
Tilbud om målrettet genetisk hjertescreening for idrettsutøvere
Norsk cardiologisk selskap anbefaler i en artikkel [290] i Tidsskriftet for den norske legeforening gradvis innføring av genetisk hjertescreening for utvalgte grupper av idrettsutøvere. De viser til at en sentral begrunnelse for å innføre hjertescreening i idrett er at personer med underliggende hjertesykdommer, som genetiske tilstander eller udiagnostiserte rytmeforstyrrelser, har økt risiko for hjertestans under fysisk aktivitet. Et slikt tilbud kan bidra til tidlig identifisering av disse tilstandene, slik at nødvendige risikoreduserende tiltak kan iverksettes.
[280] Hos ca. 20 til 25 prosent av barna som får funn av sykdom gjennom nyfødtscreeningen, er det allerede tegn og symptomer på sykdom når funnet i nyfødtscreeningen svares ut.
[282] Lancet T (2023). Genomic newborn screening: current concerns and challenges. Lancet (London, England). 2023 Jul 22;402(10398):265.
[284] Gidding SS et al. (2022). Paediatric familial hypercholesterolaemia screening in Europe: public policy background and recommendations. European journal of preventive cardiology. 2022 Dec 14;29(18):2301-11.
[285] Se step 3 i Improving prevention and control of raised cholesterol. A call to action. (PDF, world-heart-federation.org)
[286] Hundreds of people at increased cancer risk identified by new NHS BRCA testing programme (england.nhs.uk) og The NHS Jewish BRCA Testing Programme (jewishbrca.org)
[288] Heramb C et al. (2018). BRCA1 and BRCA2 mutation spectrum – an update on mutation distribution in a large cancer genetics clinic in Norway. Hereditary cancer in clinical practice. 2018 Jan 10;16(1):3.