I enkelte land tilbys pasienter som gjennomgår genetisk testing, utvidede genetiske undersøkelser utover det som er direkte relevant for den aktuelle kliniske problemstillingen. Slike genetiske undersøkelser går under ulike navn [291]. Vi har valgt begrepene «sekundære undersøkelser» og «undersøkelse av sekundære funn». Undersøkelsen er et ekstra genpanel med kjente sykdomsgivende genvarianter som man aktivt søker etter. Panelet som brukes varierer noe. Hensikten er å finne genetiske sykdomsvarianter som kan forebygges eller behandles. Av økonomiske og praktiske grunner gjøres gjerne en slik utvidet undersøkelse når man allerede har gjennomført en genomsekvensering, for eksempel ved utredning i helsetjenesten eller som ledd i større forsknings- og implementeringsprosjekter, slik som 100 000 Genomes Project [292] i Storbritannia. Eventuelle funn som gjøres i en slik kontekst, kalles «tilleggsfunn» (eng. additionally findings, AF) eller «sekundære funn» (eng. secondary findings, SF).
I dag gjøres ikke undersøkelser av sekundære funn i Norge, men enkelte andre land praktiserer dette. I dette kapittelet gjennomgår vi praksis i flere land hvor det er tatt aktiv stilling til denne typen undersøkelser. Overordnet ser vi at det er spredning i hvordan man forholder seg til undersøkelser av sekundære funn. Det europeiske selskapet for humangenetikk (ESHG) foreslår en forsiktig tilnærming til analyse av sekundære funn. Også German Society of Human Genetics (2013), Health Council of the Netherlands (2015) og French Agency of Biomedicine (2020) foreslår at dette gjøres med en viss tilbakeholdenhet. American College of Medical Genetics and Genomics (ACMG) har en mer liberal holdning til undersøkelser av sekundære funn. Etter anbefalingene fra ACMG har ulike versjoner av denne tilnærmingen blitt foreslått eller tatt i bruk i flere europeiske land, blant annet i Storbritannia (100,000 Genomes Project) og Frankrike [293].
Dagens regulering
Bioteknologiloven
Undersøkelse av sekundære funn, det vil si forebyggende tilleggsundersøkelse uten medisinsk indikasjon, vil være en prediktiv [294] undersøkelse som medfører krav til tilpasset genetisk veiledning, skriftlig samtykke til undersøkelsen, og at undersøkelsen skal rekvireres fra godkjent virksomhet. Prediktive undersøkelser kan bare utføres på barn under 16 år, dersom undersøkelsen kan påvise forhold som ved behandling kan forhindre eller redusere helseskade hos barnet.
Bestemmelsen om anvendelse av genetiske undersøkelser til medisinske formål med diagnostiske og behandlingsmessige konsekvenser i bioteknologiloven § 5-2 har en ordlyd som tilsynelatende ikke inkluderer forebyggende formål [295]. I I forarbeidene til loven vurderte departementet at i den grad det er medisinsk indikasjon for å iverksette forebyggende tiltak for å bedre prognosen for aktuelle sykdom, vil dette falle under behandlingsmessige tiltak.
«Ved å utvide anvendelsesområdet til også å omfatte forebyggende siktemål, vil det etter departementets syn innebære at det åpnes for generell screening av pasienter hvor det ikke er grunnlag for å anta at det foreligger sykdomsdisposisjon. Departementet har ikke fått tilbakemeldinger om at gjeldende bestemmelse har vært til hinder for å få utført genetisk undersøkelser som har vært vel begrunnet. Departementet foreslår derfor å videreføre denne bestemmelsen i lovforslagets § 5–2.»
Biomedisinkonvensjonen
Biomedisinkonvensjonen artikkel 12 sier at prediktive tester «må bare utføres til helseformål eller til vitenskapelig forskning knyttet til helseformål, og under forutsetning av tilstrekkelig genetisk rådgivning».
Biomedisinkonvensjonen artikkel 10 [296] pkt. 2 sier at «Enhver har krav på å få kjennskap til enhver opplysning som samles inn om hans eller hennes helse. Enkeltpersoners ønsker om ikke å bli gjort kjent med dette, skal imidlertid respekteres ».
Dagens praksis
De medisinsk-genetiske avdelingene utfører i dag ikke undersøkelser av sekundære funn. De bidrar til forebygging ved å tilby presymptomatiske, prediktive og bærerdiagnostiske genetiske undersøkelser, som regel til familiemedlemmer til pasienter som har fått påvist en genetisk sykdomsvariant. Gjennom genetisk veiledning og videre genetiske undersøkelser av familiemedlemmer blir det i praksis «kaskadetesting», se faktaboks 6-3.
Faktaboks 6-3: Kaskadetesting (familietesting, testing av slektninger)
Kaskadetesting er prosessen der familiemedlemmer informeres om en genetisk tilstand som er oppdaget i familien. Familiemedlemmer som ønsker det, vil deretter få tilbud om å testes for tilstanden.
Helsedirektoratet skrev i vedlegget til Genomutredningen om hensikten med kaskadetesting: Presymptomatisk testing av familiemedlemmer kan fange opp personer som har høy risiko for sykdom uten å vite om det selv. I noen familier er det kjent opphopning av arvelig sykdom uten at man kjenner årsaken. I slike tilfeller blir ofte nære slektninger fulgt opp med jevnlige kontroller for å kunne oppdage sykdom tidlig, eller forebygge alvorlig sykdom. Dersom det blir påvist en sykdomsgivende genetisk variant i slekten, kan de familiemedlemmene som ikke har varianten, fritas fra kontrollregime, siden de ikke har høyere risiko for familiens sykdom enn befolkningen ellers. Foreldre til et barn med en alvorlig tilstand hvor den genetiske årsaken er kjent, kan få tilbud om fosterdiagnostikk eller preimplatasjonsgenetisk diagnostikk (PGD/PGT) dersom de planlegger å få flere barn.
Selv om undersøkelse av sekundære funn skiller seg fra utilsiktede funn i måten man finner dem på [297], så er det i prinsippet ofte de samme genetiske variantene som det er aktuelt å gi tilbakemelding om. Det gjelder genetiske varianter uten betydning for den kliniske tilstanden pasienten undersøkes for, men som det kan være relevant å avdekke for å kunne forebygge framtidig sykdom.
Dagens praksis er i tråd med Helsedirektoratets veileder, som anbefaler at analyser utformes slik at risikoen for funn uten relevans for den aktuelle kliniske problemstillingen reduseres til et minimum. Det europeiske selskapet for humangenetikk (ESHG) anbefalte i 2013 at genomanalyser bør begrenses til å gjelde det opprinnelige helseproblemet, i alle fall foreløpig. Dagens praksis er derfor også i henhold til anbefalingene fra 2013. Imidlertid ga ESHG i 2021 ut en artikkel hvor de åpner mer opp for undersøkelse av sekundære funn, og anbefaler en forsiktig tilnærming til det [298]. Veilederen fra direktoratet vil vurderes i lys av disse endringene.
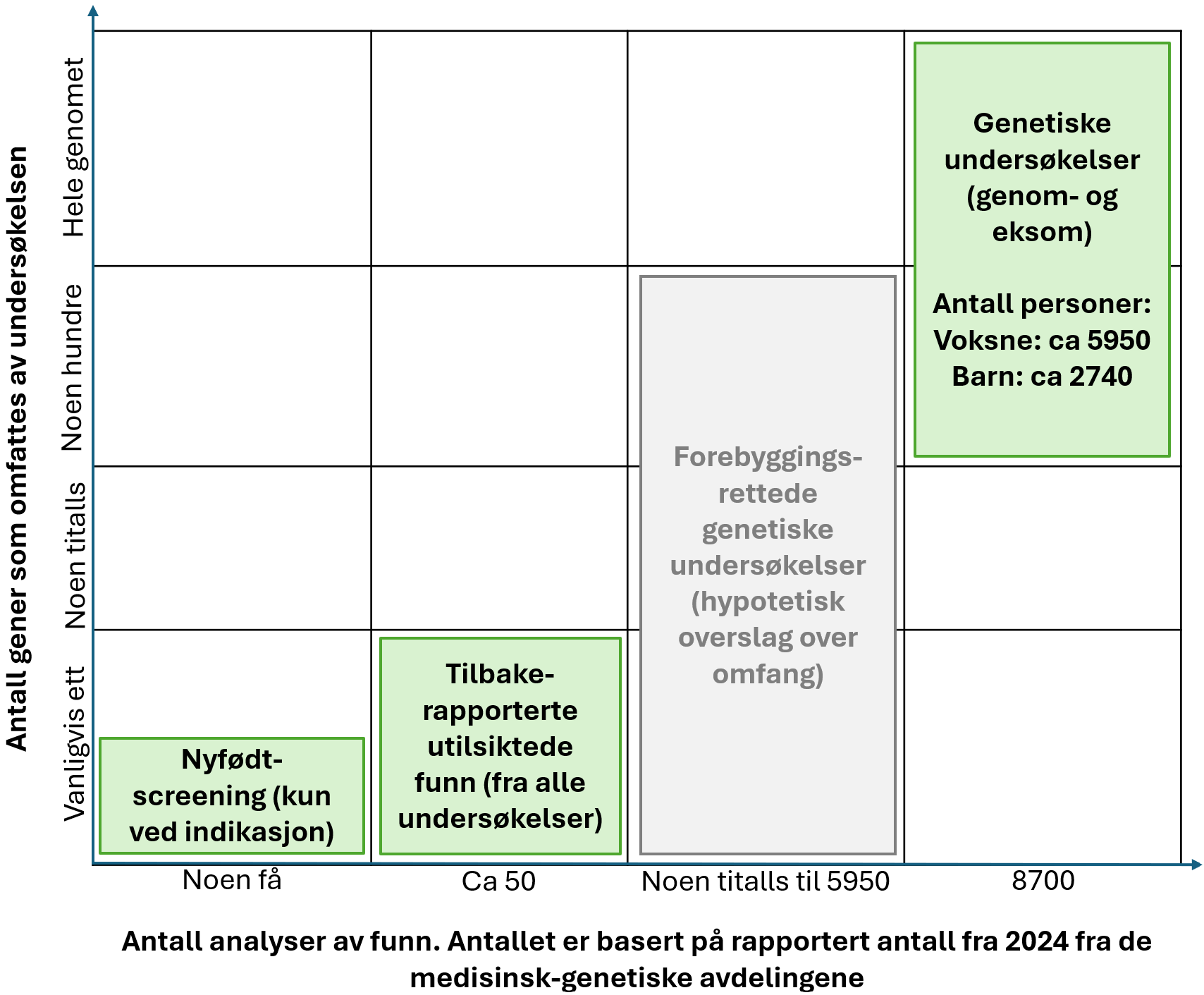
Forklaring til figuren: Figuren over viser et tentativt overslag over omfanget av forebyggingsrettede genetiske undersøkelser, sett i forhold til noen typer genetiske undersøkelser som ble gjennomført ved medisinsk-genetiske avdelinger i 2024. Tallene er basert på de medisinsk-genetiske avdelingenes rapportering til Helsedirektoratet om bruk av genetiske undersøkelser i helsetjenesten.
Den horisontale aksen er antall analyser som er gjort, basert på rapportert antall fra 2024 fra de medisinsk-genetiske avdelingene.
Den vertikale aksen er antall gener som omfattes av hver type undersøkelse.
Tre grønne bokser viser undersøkelser i regi av de medisinsk-genetiske avdelingene hvor pasienten eller foresatte får tilbakemeldinger på funn i dag. Dette er nyfødtscreeningen, tilbakemelding av utilsiktede funn, og genetiske undersøkelser (genom- og eksom).
Første grønne boks viser nyfødtscreeningen. I nyfødtscreeningen gjøres det umiddelbart genetiske undersøkelser for å bekrefte unormale funn i biomarkørmønster før det gis tilbakemelding. I noen få tilfeller med høy hastegrad og klare funn fra første screeningtest (1. tier) gis det tilbakemelding om funnet før det er gjort en bekreftende genetisk undersøkelse, men i slike tilfeller blir den genetiske undersøkelsen utført parallelt [299].
Andre grønne boks viser tilbakemelding av utilsiktede funn. Tilbakemeldinger ble gjort i 51 tilfeller i 2024. Slik tilbakemelding gjelder normalt funn av én sykdomsgivende genvariant.
Neste boks er grå og viser et overslag over hvor omfattende bruken av undersøkelser av sekundære funn hypotetisk kunne ha vært i 2024. Bruken kan skaleres i stor grad, både med tanke på antall personer som kan tilbys undersøkelsene og hvilke gener og genvarianter som undersøkes. Ved bruk av piloter kan antallet personer være svært lavt. Det største antall personer som kunne fått tilbudet er alle voksne som får genom- og eksomundersøkelser. I 2024 gjaldt dette 5 954 personer.
Den tredje og siste grønne boksen viser genom- og eksomundersøkelser gjennomført av de medisinsk-genetiske avdelingene i 2024. Dette omfatter 5 954 genom- og eksomundersøkelser av voksne, og 2 742 av barn. I disse undersøkelsene leter man etter sykdomsvarianter som forårsaker pasientens symptomer, og omfanget av undersøkelsen kommer an på pasientens symptomer.
Internasjonale standpunkt og erfaringer
European Society of Human Genetics
Det europeiske selskapet for humangenetikk (ESHG) anbefalte i 2013 at genomanalyser foreløpig bør begrenses til å gjelde det opprinnelige helseproblemet. I 2021 åpnet de noe mer opp i en artikkel [298] og anbefalte der «en forsiktig tilnærming til screening for sekundære funn» [300]. Videre sa de at
«prinsippene om proporsjonalitet og autonomi må ivaretas, og i offentlig finansierte helsevesen må potensielle gevinster veies opp mot kostnader. Når det gjelder genomsekvensering hos barn, mener ESHG at det er for tidlig å undersøke for tilstander med sen debut. Genetisk veiledning bør tilbys, og informert samtykke er – og bør forbli – en grunnleggende etisk norm».
Videre nevnte ESHG at pilotprosjekter kan være nyttige for å samle inn data til sammenlignende analyse av forebyggingsrettede genetiske undersøkelser og viktige alternativer, som for eksempel kaskadetesting.
American College of Medical Genetics and Genomics, USA
I USA har American College of Medical Genetics and Genomics (ACMG) utarbeidet retningslinjer [301] som anbefaler at pasienter bør tilbys screening for medisinsk handlingsutløsende sykdomsfremkallende genvarianter (sekundære funn). De anbefaler at man bevisst bør lete etter og rutinemessig analysere et forhåndsdefinert sett med «handlingsrelevante» genetiske varianter hver gang det gjøres en eksom- eller genomsekvensering – uavhengig av hvorfor testen ble gjort. Dette innebærer at laboratorier bevisst leter etter visse genetiske varianter som ikke er direkte knyttet til den opprinnelige årsaken til den genetiske undersøkelsen.
Faktaboks 6-4: Klinisk handlingsutløsende og handlingsrelevante varianter
Det brukes flere begreper for å beskrive hvordan man plukker ut genetiske varianter for undersøkelse av sekundære funn. Begrepene brukes litt ulikt fra kilde til kilde. I vår rapport vil vi bruke dem som beskrevet i denne faktaboksen.
Klinisk handlingsutløsende genetiske varianter
Klinisk handlingsutløsende (eng. clinically actionable) genetiske varianter refererer til genetiske varianter som kan behandles eller håndteres med medisinske intervensjoner. Dette kan inkludere medisiner, kirurgi, eller andre medisinske behandlinger som kan redusere symptomer, eller hindre eller utsette sykdomsutvikling.
Handlingsrelevante genetiske varianter
Handlingsrelevante (eng. actionable) genetiske varianter er genetiske varianter som gir informasjon som kan brukes til å ta beslutninger om forebyggende tiltak, livsstilsendringer, eller andre ikke-medisinske intervensjoner. Dette kan inkludere endringer i kosthold, økt overvåking, eller andre tiltak som kan redusere risikoen for sykdom. Hva som man regner som handlingsrelevante varierer. French Society of Predictive and Personalized Medicine definerer handlingsrelevante til at det finnes passende forebygging eller screeningprogrammer.
French Society of Predictive and Personalized Medicine (SFMPP), Frankrike
French Society of Predictive and Personalized Medicine (SFMPP) publiserte i 2018 retningslinjer for multigenpaneler for arvelige tumorsyndromer. Disse panelene inkluderer gener som ikke er relatert til den konkrete pasientens tumor, og er derfor å anse som tilleggsfunn ved genomsekvensering av kreftgener [302]. Retningslinjene omfattet blant annet klassifisering av 60 gener og forslag til prosess for å rapportere disse tilleggsfunnene tilbake til pasienten.
I klassifiseringen var penetrans [303] det viktigste vurderingskriteriet. Andre kriterier var alvorlighet (eng. severity), handlingsrelevans [304] (eng. actionability) og risiko knyttet til eventuelle tiltak. Tilgjengelig evidens på hver av kriteriene ble vurdert. Genene ble delt inn i tre klasser. 36 gener ble plassert i klasse 1 hvor det ble anbefalt å gi pasienten informasjon om tilleggsfunn.
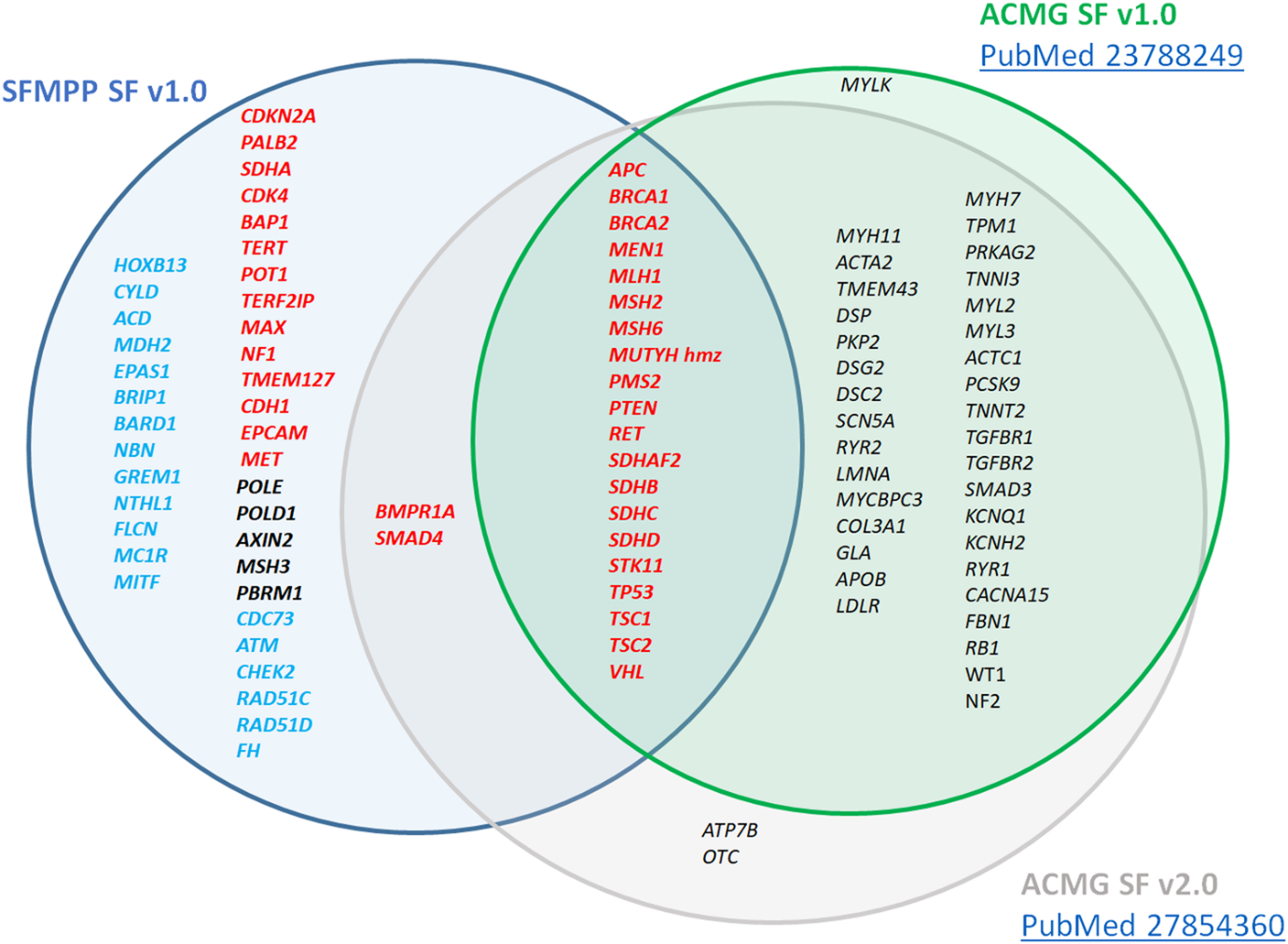
Forklaring til figuren: Figuren viser en sammenligning av French Society of Predictive and Personalized Medicine sin liste over kreftrelaterte gener (fargekodet etter hvorvidt de bør rapporteres tilbake) og American College of Medical Genetics and Genomics' vurderinger av gener anbefalt for sekundære undersøkelser, som også inkluderer en liste over kreftrelaterte gener. I SFMPP-klassifiseringen er klasse 1, 2 og 3 markert med henholdsvis rød, svart og blå farge. hmz står for homozygot.
Figuren viser at følgende handlingsrelevante kreftrelaterte gener er omfattet av både SFMPP SF v1.0 klasse 1, og versjon 1.0 og 2.0 av ACMG: APC, BRCA1, BRCA2, MEN1, MLH1, MSH2, MSH6, MUTYH (homozygot), PMS2, PTEN, RET, SDHAF2, SDHB, SDHC, SDHD, STK11, TP53, TSC1, TSC2 og VHL.
Følgende handlingsrelevante kreftrelaterte gener er omfattet både av SFMPP SF v1.0 klasse 1 og v2.0 av ACMG: BMPR1A og SMAD4.
En del kreftrelaterte gener finnes bare i SFMPP SF v1.0. Klasse 1. Dette er CDKN2A, PALB2, SDHA, CDK4, BAP1, TERT, POT1, TERF2IO, MAX, NF1, TMEM127, CDH1, EPCAM og MET. Klasse 2 omfatter genene POLE, POLD1, AXIN2, MSH3 og PBRM1. Klasse 3 omfatter HOXB13, CYLD, ACD, MDH2, EPAS1, BRIP1, BARD1, NBN, GREM1, NTHL1, FLCN, MC1R, MITF, CDC73, ATM, CHEK2, RAD51C, RAD51D og FH.
Videre er det en del gener som bare er i ACMGs lister, siden deres lister også omfatter andre gener enn de som er relatert til kreft. ACMG SF v1.0 omfatter, i tillegg til de som er felles for SFMPP SF v1.0, også MYH11, ACTA2, TMEM43, DSP, PKP2, DSG2, DSC2, SCN5A, RYR2, LMNA, MYCBPC3, COL3A1, GLA, APOB, LDLR, MYH7, TPM1, PRKAG2, TNNI3, MYL2, MYL3, ACTC1, PCSK9, TNNT2, TGFBR1, TGFBR2, SMAD3, KCNQ1, KCNH2, RYR1, CACNA15, FBN1, RB1, WT1 og NF2. ACMG SF v1.0 omfatter også genet MYLK, som ikke ble videreført da v2.0 av listen ble laget. Genene ATP7B og OTC er bare i ACMG SF v2.0.
SFMPPs retningslinjer inneholder også forslag til prosess for å rapportere tilleggsfunn tilbake til pasienten [306]. SFMPP anbefaler å utføre genomsekvensering for kreftdisponerende gener samtidig med diagnostisk krefttesting, og la pasientene velge om de ønsker å motta eller avslå informasjonen om disse genene på tidspunktet for resultatformidlingen. En fordel med denne metoden er at den er tidsbesparende. En potensiell ulempe er at den kanskje ikke i tilstrekkelig grad ivaretar prinsippene om informert samtykke, siden det kan komme brått på. Retningslinjene presiserer at pasientens autonomi skal respekteres, og pasienter når som helst kan ombestemme seg og slippe å motta denne informasjonen.
SFMPP har laget en standardisert video om å motta tilleggsfunn, som brukes i tillegg til øvrig informasjon som gis.
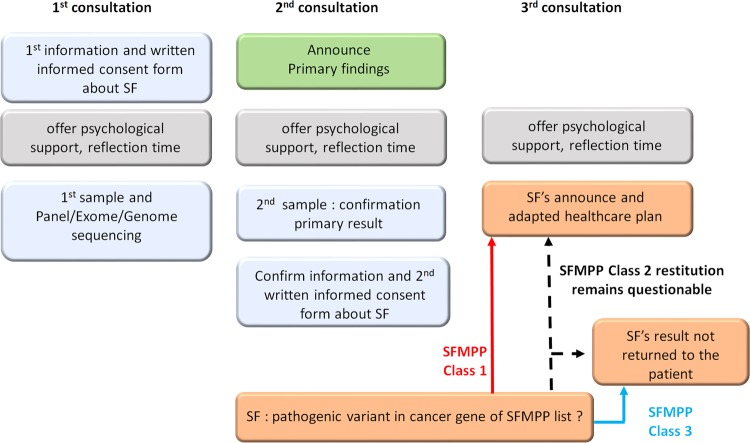
Forklaring til figuren: Prosessen viser temaer for tre påfølgende konsultasjoner. I første konsultasjon får personen informasjon om mulighet for tilleggsfunn, og skriver under på at et foreløpig ønske om informasjon om dette. Vedkommende får tilbud om psykologisk støtte og tid til refleksjon både i denne og de påfølgende to konsultasjonene. I andre konsultasjon får pasienten resultater knyttet til den primære årsaken til at pasienten fikk gjennomført genetisk undersøkelse. I tillegg får pasienten mulighet til å bekrefte eller avslå at vedkommende ønsker å vite om eventuelle tilleggsfunn. I tredje konsultasjon overbringes resultatene fra de sekundære undersøkelsene. Dersom pasienten har en variant i gen fra SFMPP klasse 1, blir resultatet formidlet til pasienten og oppfølgingstiltak planlegges. Skulle funnet være i gen fra klasse 2 er det mer usikkert hvorvidt funnet bør rapporteres tilbake til pasienten, og besluttes etter en individuell vurdering. Resultater fra klasse 3 fra SFMPP blir ikke returnert til pasienten.
Canadian College of Medical Geneticists, Canada
Canadian College of Medical Geneticists (CCMG) skrev i sine anbefalinger [307] i 2015 at «inntil nytteverdien av å rapportere utilsiktede funn er godt dokumentert, anbefales det ikke å gjennomføre målrettet klinisk analyse av sykdomsrelaterte gener som ikke har tilknytning til den primære problemstillingen». I 2021 anbefalte de at tilleggsfunn ikke rutinemessig bør rapporteres tilbake hos ufødte [308].
Genomics England, Storbritannia
Genomics England tilbød deltakerne i prosjektet 100 000 Genomes tilbakemelding om sekundære funn. Det er gjennomført mye forskning på dette i ettertid. En artikkel konkluderte med at pasientenes erfaringer med å motta sekundære funn var i hovedsak positive, og det er støtte for å tilby slike funn som en rutinemessig del av helsetjenesten. En annen konkluderte med forsiktig tilnærming:
«Fageksperter i Storbritannia mener at det foreløpig mangler tilstrekkelig kunnskapsgrunnlag for å utforme politikk knyttet til sekundærfunn, og anbefaler derfor en forsiktig tilnærming» [309].
Vi har ikke funnet artikler som viser at tilbakemelding av tilleggsfunn har hatt negative konsekvenser for pasientene [310]. Flere av artiklene gir råd om hvordan forebyggingsrettede genetiske undersøkelser bør gjennomføres, og kan være relevante å gjennomgå dersom undersøkelse av sekundære funn skal vurderes for den norske helsetjenesten. Eksempler på råd er å vie særskilt oppmerksomhet til samtykkeprosessen [311], og styrke oppfølgingen for personer som får tilbakemelding om et sekundært funn [312].
Blueprint genetics, Finland – eksempel på privat aktør for genetisk testing
Det finske selskapet Blueprint Genetics har kunder i over 70 land. De tilbyr «proaktiv test» for «personer som ønsker mer informasjon om sin risiko for å utvikle visse klinisk handlingsutløsende tilstander med debut i voksen alder, som for eksempel kreft og hjertesykdommer» [313]. Dette er et eksempel på et privat selskap som tilbyr en undersøkelse av sekundære funn hvor man leter etter tilleggsfunn. Ifølge informasjonen på deres nettsted dekker den mest omfattende testen 181 gener. Variantene som dekkes av testen er patogene eller sannsynlig patogene, og består av varianter fra ACMGs liste over «medically actionable» sykdommer med enkelte tillegg.
Problemstillinger
Systematisk tilrettelegging for forebyggende genetiske undersøkelser for voksne i Norge?
European Society of Human Genetics anbefaler en forsiktig tilnærming til forebyggingsrettede genetiske undersøkelser hos voksne, men at man ikke skal lete etter sykdommer med sen debut hos barn. Genetisk veiledning bør tilbys, og informert samtykke er og bør forbli en sentral etisk norm. Andre organisasjoner som har argumentert for at «behandlingsrelevante» genetiske varianter bør eller kan rapporteres inkluderer American College of Medical Genetics and Genomics, French Society of Predictive and Personalized Medicine og Genomics England.
Utfordringer ved bruk av undersøkelse av sekundære funn er knyttet til psykologiske, sosiale og medisinske faktorer, ifølge European Society of Human Genetics (2021). Vi går i den følgende teksten gjennom viktige for- og motargumenter.
Nytte vs. kostnader
En undersøkelse av sekundære funn er en type genetisk screening som gjøres uten medisinske indikasjoner for å utføre den aktuelle testen. Dette betyr at det er en mer usikker balanse mellom nytte og risiko.
American College of Medical Genetics and Genomics anbefaler undersøkelse av en rekke sykdomsvarianter i litt over 200 gener [314]. Et så omfattende panel er ikke en forutsetning for et eventuelt tilbud i Norge. Det vil trolig være mer naturlig å starte med en svært restriktiv liste og teste ut bruk av denne listen ved å gi tilbakemelding om disse sykdomsvariantene i pilotprosjekter. Inkludering av genetiske varianter som forårsaker alvorlige bivirkninger av anestesi i tillegg til enkelte farmakogenetiske varianter kan, ifølge European Society of Human Genetics, øke nytten av panelet. Inkludering av genvarianter relevante for reproduksjon er også nevnt som en mulighet.
Helseøkonomiske forhold må tas i betraktning, og det må avklares hvilken del av populasjonen som skal få et eventuelt tilbud. I utlandet gjennomføres undersøkelse av sekundære funn som et ekstra panel for pasienter som allerede har fått en genetisk undersøkelse. Bakgrunnen for å velge denne målgruppen er at det er rimelig – sekvenseringen er da allerede gjort, pasienten er allerede inne i et system med veiledning og oppfølging, og siden mye av tolkningen gjøres maskinelt, blir ekstrautgiftene relativt lave. Dette gjør at man potensielt kan få mye helse for pengene.
Dersom man gir tilbakemeldinger ved funn av høypenetrante sykdomsvarianter knyttet til alvorlige sykdommer som det finnes behandling for, vil de som får tilbakemelding trolig være et utvalg av befolkningen som uansett vil komme til helsetjenesten med denne sykdommen på et senere tidspunkt. Ved undersøkelse av sekundære funn fanges personer med risiko opp tidligere og sykdommen kan bremses eller behandles. Pasientene kan innlemmes i oppfølgingsprogrammer og det blir mulig å gjennomføre kaskadetesting av slektninger.
Et argument mot undersøkelse av sekundære funn er at det uansett er noe manuelt arbeid ved tolkning av disse resultatene. En slik undersøkelse er en prediktiv genetisk test, som etter dagens regelverk medfører ekstra plikter og rettigheter. Pasientene må få veiledning, samtykke til undersøkelsen og kan trenge oppfølging fra helsetjenesten tidligere enn om de hadde kommet inn med sykdom noen år senere.
Forskjellsbehandling?
Et argument mot undersøkelse av sekundære funn er at det å gi en ekstra undersøkelse til de som allerede har fått en genetisk undersøkelse, innebærer forskjellbehandling. Sannsynligheten for å finne de sykdomsgivende variantene er like stor i den delen av befolkningen som ikke har tatt genetisk test fra før. Skulle et slikt tilbud etableres, vil det derfor være naturlig å vurdere om resten av befolkningen skal tilbys den samme genetiske undersøkelsen på sikt. Dersom undersøkelse av sekundære funn tilbys til flere enn de som allerede har tatt en genetisk undersøkelse, vil tilbudet bli mer rettferdig overfor personer som har de samme genetiske sykdomsvariantene. Et tilbud til en større gruppe vil imidlertid gi større ressursbruk.
Praktiske utfordringer
Det medfører også praktiske utfordringer som må løses. Eksempel på dette er når informasjon om mulighet for undersøkelse av sekundære funn skal gis, hvordan samtykket bør være, og når eventuelle funn skal meldes tilbake til pasienten.
Skulle det bli aktuelt å tilby undersøkelse av sekundære funn, er det en rekke faktorer som bør utredes eller undersøkes. Penetransen til sykdomsvariantene kan være lavere og usikker dersom man ikke har familiehistorikk med sykdommen, og variantene som det skal rapporteres på må derfor velges med omhu for å forhindre ubegrunnede bekymringer, unødige behandlinger og tiltak, og langvarig psykisk stress ved overvåking av eventuell sykdomsutvikling. European Society of Human Genetics (2021) [315] uttaler derfor at 1) den positive prediktive verdien av sykdomsvariantene i panelet må være høy, 2) effektiviteten av de forebyggende intervensjonene eller tiltakene som anbefales til de som er funnet å være i risiko bør være vitenskapelig bevist, og 3) tilgang til disse intervensjonene samt relevant rådgivning må være garantert.
Ivaretakelse av pasientens autonomi og retten til ikke å vite
Forskning [316], [317] har vist at de som får vite at de har et sykdomsgen for en behandlingsbar sykdom, på sikt er takknemlige for å ha denne kunnskapen. En liten andel takker nei til denne informasjonen, og retten til ikke å vite må derfor ivaretas dersom det åpnes for undersøkelse av sekundære funn.
[291] Det brukes en rekke andre navn, som «forebyggingsrettet genetisk undersøkelse» eller «mulighetsbasert (eng. opportunistic) undersøkelse».
[292] Disse analysene har ulike navn. Eksempelet «Additional findings analysis» er hentet fra 100,000 Genomes Project (genomicsengland.co.uk)
[293] Pujol et al. (2018). Guidelines for reporting secondary findings of genome sequencing in cancer genes: the SFMPP recommendations European Journal of Human Genetics. 2018 Dec;26(12):1732-42.
[294] Det er også mulig å legge til panel for bærerdiagnostiske undersøkelser, selv om dette ikke ser ut til å være standard
[295] Se tilråding fra Helsedepartementet av 11. april 2003: Ot.prp. nr. 64 (2002-2003) Om lov om medisinsk bruk av bioteknologi m.m. (bioteknologiloven), 5.5.4.
[296] Konvensjon om beskyttelse av menneskerettighetene og menneskets verdighet i forbindelse med anvendelsen av biologi og medisin: Konvensjon om menneskerettigheter og biomedisin - ETS nr. 164 (lovdata.no)
[297] Forskjellen på om funnet kalles sekundært eller utilsiktet funn er om man aktivt har lett etter funnet (sekundært funn/tilleggsfunn), eller om det oppdages tilfeldig (utilsiktet)
[298] de Wert G et al. (2021). Opportunistic genomic screening. Recommendations of the European Society of Human Genetics. European Journal of Human Genetics. 2021 Mar;29(3):365-77.
[299] Beskrevet i Kapittel 1.2 «Hva skiller screening fra annen helsehjelp» i rapporten «Forslag til endringer i prosess for inkludering av nye sykdommer i nyfødtscreeningen»
[300] «Forebyggingsrettet screening» er begrepet som brukes i denne artikkelen
[301] Miller DT et al. (2023). ACMG SF v3.2 list for reporting of secondary findings in clinical exome and genome sequencing: A policy statement of the American College of Medical Genetics and Genomics (sciencedirect.com). Genetics in Medicine. 2023 Aug 1;25(8):100866.
[302] Pujol et al. (2018) Guidelines for reporting secondary findings of genome sequencing in cancer genes: the SFMPP recommendations (nature.com). European Journal of Human Genetics. 2018 Dec;26(12):1732-42.
[303] «Penetrans» omfatter her debutalder og hvorvidt varianten er medfødt, og de vektet penetrans høyere enn øvrige vurderingskriterier
[304] «Handlingsrelevans» er her definert til at det finnes passende forebygging eller screeningprogrammer
[305] Pujol, P. et al. (2018) Guidelines for reporting secondary findings of genome sequencing in cancer genes: the SFMPP recommendations (nature.com) European Journal of Human Genetics. 2018 Dec;26(12):1732-42.
[306] «Recommended steps for reporting secondary findings to the patient» fra Pujol, P et al. (2018) Guidelines for reporting secondary findings of genome sequencing in cancer genes: the SFMPP recommendations (nature.com). European Journal of Human Genetics. 2018 Dec;26(12):1732-42.
[307] Boycott K et al. (2015) The clinical application of genome-wide sequencing for monogenic diseases in Canada: Position Statement of the Canadian College of Medical Geneticists (pubmed.ncbi.nlm.nih.gov) Journal of Medical Genetics. 2015 Jul 1;52(7):431-7.
[308] Joanna Lazier et al. (2021) Clinical application of fetal genome-wide sequencing during pregnancy: position statement of the Canadian College of Medical Geneticists (jmg.bmj.com) Journal of Medical Genetics. 2022 Oct 1;59(10):931-7.
[309] Elizabeth Ormondroyd et al. (2018) «Not pathogenic until proven otherwise»: perspectives of UK clinical genomics professionals toward secondary findings in context of a Genomic Medicine Multidisciplinary Team and the 100,000 Genomes Project (sciencedirect.com) Genetics in Medicine. 2018 Mar 1;20(3):320-8.
[310] Vi har ikke gjort en systematisk gjennomgang av artiklene, men gått gjennom artikler som ut fra titlene virket relevante for arbeidet med bioteknologiloven
[311] Joshua J. Nolan et al. (2024) Additional findings from the 100,000 Genomes Project: A qualitative study of recipient perspectives (sciencedirect.com) Genetics in Medicine. 2024 Jun 1;26(6):101103
[312] Bethany Stafford-Smith et al. (2025) Evaluating the return of additional findings from the 100,000 Genomes Project: A mixed methods study exploring participant experiences of receiving secondary findings from genomic sequencing (sciencedirect.com) Genetics in Medicine. 2025 Apr 19:101446.
[314] ACMG Recommendations for Reporting of Secondary Findings in Clinical Exome and Genome Sequencing (ncbi.nlm.nih.gov) og ACMG SF v3.2 list for reporting of secondary findings in clinical exome and genome sequencing: A policy statement of the American College of Medical Genetics and Genomics (ACMG) (gimjournal.org)
[315] de Wert G et al. (2021) Opportunistic genomic screening. Recommendations of the European Society of Human Genetics (nature.com) European Journal of Human Genetics. 2021 Mar;29(3):365-77.
[316] Hart MR et al. (2019) Secondary findings from clinical genomic sequencing: prevalence, patient perspectives, family history assessment, and health-care costs from a multisite study (nature.com) Genetics in Medicine. 2019 May;21(5):1100-10.
[317] Nolan JJ et al. (2024b) Additional findings from the 100,000 genomes project: A qualitative study of recipient perspectives (pubmed.ncbi.nlm.nih.gov) Genetics in Medicine. 2024 Jun 1;26(6):101103.