I dette kapittelet omtaler vi regelverk for PGD i våre nordiske naboland. Vi har også innhentet data og annen informasjon om PGD fra kontaktpersoner ved klinikker i Danmark, Finland og Sverige. Til slutt i kapittelet viser vi siste oppdaterte data fra European Society of Human Reproduction and Embryology (ESHRE).
Regelverk og tilbud i Sverige
Regelverk
PGD/PGT er regulert i Lag (2006:351) om genetisk integritet [107] kapittel 4 § 2.
«Villkor för preimplantatorisk genetisk diagnostik
2 § Preimplantatorisk genetisk diagnostik får användas endast om mannen eller kvinnan bär på anlag för en allvarlig monogen eller kromosomal ärftlig sjukdom, som innebär en hög risk för att få ett barn med en genetisk sjukdom eller skada.
Behandlingen får inte användas för val av egenskap utan endast inriktas på att barnet inte skall ärva anlag för sjukdomen eller skadan i fråga.
Preimplantatorisk genetisk diagnostik får inte utan tillstånd av Socialstyrelsen användas för att försöka få ett barn med en sådan genuppsättning att barnet skulle kunna bli donator av blodstamceller till ett svårt sjukt syskon. Tillstånd får lämnas endast om det finns synnerliga skäl för att tillåta användning.»
Virksomhetene og regionene har regler for offentlig finansiert tilbud om fertilitetsbehandling som vil gjelde i tillegg, og som for eksempel setter begrensninger for hvor mange barn kvinnen eller paret kan få. Nedenfor hovedpunktene fra Karolinska sjukhuset i Stockholms län [108].
- Det skal være teknisk mulig å utføre PGD. Det innebærer bl.a. at det er mulig å finne genetiske markører for sykdommen.
- Det må være medisinsk mulig å gjennomføre PGD. Blant annet vurderes kvinnens eggreserver.
- Prioritering: Hvis paret ikke har friske barn fra før, kan de få PGD for å eventuelt få inntil to barn. Hvis de har et friskt barn fra før, kan de få PGD for å få ett friskt barn til. Hvis paret har fått lagret embryo, og har fått to friske barn med PGD, henvises de til privat virksomhet for å få overført embryo.
Det framgår av nasjonale anbefalinger at man skal være restriktiv med å starte behandling med PGD etter at kvinnen har fylt 40 år, fordi sjansene for å bli gravid reduseres.
Data om behandlinger
Socialstyrelsen publiserer rapporter om PGD. De siste tilgjengelige tallene er fra 2023 [109]. Nye tall innhentes i 2025.
Tall fra 2023:
- Dette året var det til sammen unike 339 par eller enslige kvinner som var under behandling med PGD. Av disse var det 189 som var til førstegangsbehandling.
- Gjennomsnittlig ventetid fra det ble sendt henvisning (henvisningsdato) til kvinnen hadde startet hormonstimulering var 11 måneder.
- Det var 289 kvinner eller par som fikk PGD pga. monogen sykdom (enkeltgen-sykdommer, PGT-M) og 83 som fikk PGD pga. strukturelle kromosomforandringer (PGT-SR).
- Det tok i gjennomsnitt 75 dager å få utført den genetiske analysen.
- Gjennomsnittsalder for kvinnene som gjennomgikk en eller flere egguthentinger for behandling med PGD var 33 år.
- Embryooverføringer per hormonstimulering: 53.3 prosent for PGT-SR og 55.7 prosent for PGT-M.
Resultater om fødsler etter behandling utført i 2021 og 2022 foreligger [110]:
- PGT-M (PGT for monogen sykdom)
- 2021: Andel levendefødte barn per embryooverføring var 35.5 prosent. Det ble født 77 barn etter behandlingene.
- 2022: Andel levendefødte barn per embryooverføring var 45.5 prosent. Det ble født 90 barn etter behandlingene.
- PGT-SR (PGT for strukturelle kromosomavvik)
- 2021: andel levendefødte barn per embryooverføring var 30 prosent. Det ble født 12 barn etter behandlingene.
- 2022: andel levendefødte barn per embryooverføring var 28.6 prosent. Det ble født 12 barn etter behandlingene.
Mer utdypende om indikasjoner
Direktoratet har innhentet mer detaljert informasjon om indikasjoner og behandlinger fra Karolinska Universitetssjukhuset [111]. Denne virksomheten behandlet tidligere mange av parene som fikk innvilget behandling med PGD i Norge. Vår kontakt oppgir at sykehuset gjør ca. 250 behandlinger hvert år, og tar inn ca. 170 nye pasienter per år. PGD tilbys ved alvorlig arvelig sykdom. Det er uvanlig at det sendes henvisning til PGD for sykdom som ikke anses som alvorlig. Hvis det er usikkerhet om sykdommen kan anses som alvorlig, tas beslutning i samråd med behandlingsteamet.
Faktaboks 3-1
Det finnes ingen liste over sykdommer som anses som alvorlig/diagnoser som er godkjent for PGD. Klinikken anser arvelig kreft som alvorlig, og tilbyr for eksempel PGD for BRCA-mutasjoner og Lynch syndrom. Klinikken har gjort PGD (PGT-M) for mer enn 300 monogene sykdommer. De vanligste indikasjonene er:
- Huntingtons sykdom
- Dystrofia myotonika
- Fragilt X
- Cystisk fibrose
- Beta thalassemi
- Retinoblastom
- Neurofibromatose type 1
- BRCA1/BRCA2 (vanligste indikasjonen for PGT-M ved klinikken)
- Spinal muskelatrofi
- Duchennes muskeldystrofi
- Autosomal dominant polycystisk nyresykdom (ADPKD)
Regelverk og tilbud i Danmark
Regelverk
PGD/PGE er regulert i lov om assistered reproduktion i forbindelse med behandling, diagnostikk og forskning m.v. [112]. Det framgår at:
«§ 7. Genetisk undersøgelse af et befrugtet æg må kun foretages i de tilfælde, hvor der er en kendt og væsentlig øget risiko for, at barnet får en alvorlig arvelig sygdom.
Stk. 2. Endvidere kan genetisk undersøgelse foretages i forbindelse med assisteret reproduktion uden for kvindens krop på grund af ufrugtbarhed, hvor en sådan undersøgelse kan påvise eller udelukke en væsentlig kromosomabnormitet.
Stk. 3. Styrelsen for Patientsikkerhed kan dog efter udredning og sundhedsfaglig vurdering i konkrete tilfælde meddele tilladelse til anvendelse af præimplantationsdiagnostik ved assisteret reproduktion, hvor tungtvejende hensyn til behandling af et barn med livstruende sygdom i denne familie taler herfor.
Stk. 4. Sundhedsministeren fastsætter nærmere regler om tilladelser efter stk. 3.»
PGD kan tilbys når det kjent og vesentlig økt risiko for at det fødes et barn med en alvorlig arvelig sykdom. Det framgår av retningslinjene at sykdommens alvorlighet skal vurderes konkret [113].
«(..) Mange genmutationer viser sig med uens kliniske sværhedsgrader. Det karakteristiske er, at det samme sygdomsbillede (genmutation) har forskellig sværhedsgrad, når forskellige familier (slægter) sammenlignes, men inden for den samme familie er sværhedsgraden ofte ret konstant fra generation til generation. Det er derfor sygdommens sværhedsgrad i den ramte familie, og ikke diagnosen alene, der som hovedregel er det afgørende kriterium for, at præimplantationsdiagnostik kan overvejes. Der kan ikke opstilles en ‘positivliste’, men vil altid være tale om en dybdegående konkret vurdering, som altid skal inddrage genetisk/arvebiologisk ekspertise ved en klinisk genetisk afdeling.»
Pasienter med en del typer arvelig kreft kan tilbys PGD, bl.a. for BRCA1 og BRCA2 [114] og MEN1 [115].
Det er også tillatt å tilby PGD i forbindelse med assistert befruktning pga. infertilitet, for å påvise eller utelukke vesentlige kromosomforandringer. Det er for eksempel lov til å undersøke for trisomi 13, 18, 21, 47 eller XXY (Klinefelter) [116].
Hvis familien har et alvorlig sykt barn som trenger behandling med vevsforlikelige stamceller, kan Sundhedsstyrelsen gi tillatelse til PDG for å undersøke vevstype (HLA). Det er en forutsetning at sykdommen ikke kan behandles på annen måte. PGD for vevstype kan gjøres selv om det ikke er snakk om en alvorlig, arvelig sykdom.
Data om behandlinger
I Danmark er det to nasjonale sentre som tilbys PGD, Rigshospitalet i København og Ålborg universitetssygehus. Helsedirektoratet har innhentet mer informasjon om indikasjoner og behandlinger Afdeling for medisinsk genetik, Rigshospitalet [117].
Ifølge dansk lov, kan PGD tilbys når det er vesentlig økt risiko for alvorlig, arvelig sykdom. Det eksisterer ingen liste over tilstander som innvilges eller ikke innvilges. Det er stadig diskusjon om det er tilstander hvor det ikke bør tilbys PGD.
Afdeling for medisinsk genetik, Rigshospitalet har formidlet data om utviklingen i antall PGD-sykluser med minst en biopsi (minst ett embryo som det er tatt biopsi av) i perioden 2008 til og med 2024.
Figur 3‑1 Antall PGD-sykluser med biopsi av minst et embryo. Utvikling fra 2008 til og med 2024, Kilde: Afdeling for genetik, Rigshospitalet i Danmark.
Forklaring til figuren: Det har vært en sterk økning i antallet sykluser med PGD de siste årene. Mørk grønt felt øverst i kolonnen: PGD for monogen sykdom (PGD-M). Lilla felt nederst i kolonnen: PGD for strukturelle kromosomavvik (PGT-SR). Rigshospitalet gjør langt flere PGT-M enn PGT-SR.
Figur 3‑2 nedenfor viser en oversikt over tilstander hvor det er utført PGD for monogen sykdom i perioden. Rigshospitalet får stadig flere henvendelse om PGD for bryst- og eggstokkreft. Dette er illustrert i Figur 3‑3.
Figur 3‑2 Oversikt over tilstander hvor det er gjort PGD for monogen sykdom (PGT-M), oppsummerte tall for perioden 2008 til og med 2024. Kilde: Afdeling for genetik, Rigshospitalet, Danmark
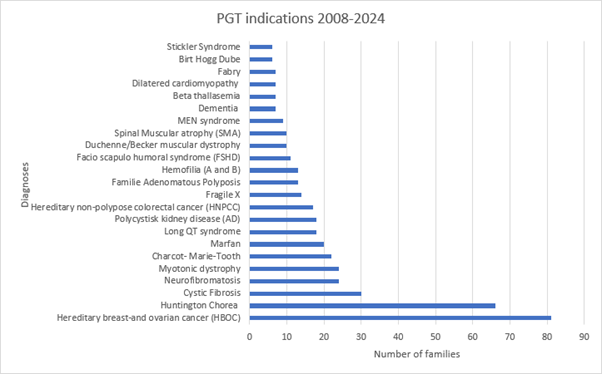
Forklaring til figuren: Figuren viser hvor mange familier som har fått PGT-M for den aktuelle sykdommen i løpet av perioden 2008 til og med 2024. Arvelig bryst- og eggstokkreft er over tid den vanligste årsaken til PGT-M, etterfulgt av Huntingtons sykdom.
Figur 3‑3 Utvikling over tid – antall familier som har fått PGD for bryst- og eggstokkreft (BRA1 eller BRCA2) i perioden 2008 til og med 2024. Kilde: Afdeling for genetik, Rigshospitalet, Danmark
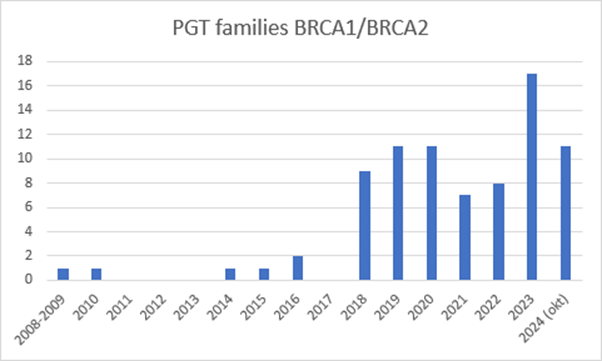
Forklaring til figuren: Figuren viser hvordan PGT-M for bryst- og eggstokkreft har utviklet seg over tid. Til sammen over 80 familier har fått utført PGT-M for arvelig kreft, jf. nederste linje i figur 3-2.
Privat tilbud
I Danmark finnes det minst en privat klinikk som tilbyr PGT-A (screening for aneuploidi) i forbindelse med assistert befruktning med ICSI [118]. Behandlingen anses som utprøvende, og omtales som særlig relevant hvis kvinnen er eldre enn 36 år, eller har hatt tre til fire spontanaborter etter assistert befruktning, eller har gjennomgått fire behandlinger med assistert befruktning uten å bli gravid.
Regelverk og tilbud i Finland
Regelverk
Genetisk undersøkelse av befruktede egg er regulert i «Lag om assisterad befruktning» [119]. Det framgår at det er det er lov å påvirke barnets helse hvis det er risiko for at barnet kan få en bestemt alvorlig sykdom. Det er lov å påvirke barnets kjønn hvis assistert befruktning skjer med parets egne kjønnsceller, og barnet har risiko for å få en alvorlig kjønnsbundet sykdom.
«5 § (finlex.fi) Inverkan på barnets egenskaper
Egenskaperna hos det barn som skall födas till följd av assisterad befruktning får genom val av könsceller eller embryon eller på något annat sätt påverkas enbart i de fall som avses i 2 och 3 mom.
Hälsan hos det barn som skall födas får påverkas genom val av könsceller eller embryon som konstaterats vara friska i fråga om en bestämd, allvarlig sjukdom. Barnets könstillhörighet får påverkas, om den assisterade befruktningen sker med parets egna könsceller och ett barn av motsatt kön med dessa könsceller skulle löpa avsevärd risk att få en allvarlig sjukdom (...)»
Data om behandlinger og indikasjoner [120]
Alle behandlinger med PGD i regi av offentlig helsetjeneste foregår ved Helsingfors universitetssjukhus (HUS). De utfører mellom 80 og 100 behandlinger med PGT for monogen sykdom (PGT-M) hvert år.
PGD-teamet ved HUS består av legespesialister innen assistert befruktning og medisinsk genetikk, i tillegg til embryolog, og disse bestemmer i fellesskap hvilke sykdommer som kan behandles. Det er krav i loven om at sykdommen må være alvorlig.
HUS oppgir at de har gjort PGT-M for ca. 170 ulike monogene sykdommer. På listen finnes sykdommer som beta-thalassemi, Duchennes muskelatrofi, Fragilt X-syndrom, spinal muskelatrofi (SMN1 og ASCC1).
HUS har gitt tilbud om PGT-M for noen arvelige kreftformer, som f.eks. familiær adenomatøs polypose (FAP/APC, en arvelig form for tarmkreft), Li-Fraumeni (TP53), retinoblastom (RB1) og arvelig kreft i magesekk og tarm (CDH1).
HUS har også gitt eksempler på sykdommer som hittil ikke har fått tilbud om PGT. Dette gjelder bl.a. dystrofia myotonica type 2, arvelige hørselssykdommer (når det ikke er andre symptomer), MODY-diabetes, og nyoppståtte genforandringer hos andre barn i familien.
HUS har til nå ikke hatt mulighet for å tilby PGT-M for BRCA1 og BRCA2, arvelig bryst- og eggstokkreft. En viktig grunn til dette er det antallet av potensielle søkere. HUS har heller ikke tilbudt PGT-M for Lynch syndrom.
Vår kontakt ved HUS har informert om at det pågår en diskusjon om PGT for c9orf72. Mutasjoner i dette genet er til stede ved en del av tilfellene av arvelig amyotrofisk lateral sklerose, ALS (20 til 50 prosent ifølge en artikkel fra 2014) [121]. Tidligere ble det ikke gjort prediktive tester for ALS/ c9orf72, men de genetiske avdelingene i Finland begynte å tilby testen i 2024, og dermed kommer det nå forespørsler om PGT-M for tilstanden. HUS uttaler at antall pasienter er så stort at de foreløpig ikke kan få tilbud om PGT.
Privat tilbud
HUS oppgir at er at det finnes tilbud om PGD ved private klinikker i Finland. Det dreier seg om mellom 10 og 20 behandlinger med PGT-M i løpet av et år. Vi har ikke lykkes med å finne mer data om dette.
Data om utvikling i bruk av PGD i Europa (ESHRE)
European Society of Human Reproduction and Embryology (ESHRE) samler årlig inn data om bruken av preimplantasjonsgenetisk testing (PGD) i Europa. Data som samles inn omfatter PGD-indikasjoner, biopsimetoder, diagnostisk teknologi, effektiviteten av de ulike prosedyrene, samt data om graviditeter og levendefødte barn. Siste rapporterte data er fra 2018, og ble publisert i 2023 [122].
Blant de utførte analysene i Europa var PGD for aneuploidi eller ubalanse i kromosomtall (PGT-A, 58 prosent) den mest utbredte, med totalt 3003 analyser gjennomført. Dette ble etterfulgt av 1388 analyser for monogen sykdom (PGT-M, 37 prosent), 462 analyser for strukturelle kromosomavvik (PGT-SR, 9 prosent), og 338 analyser for kombinert analyse av PGT-M/SR i kombinasjon med PGT-A (6 prosent).
Bruk og indikasjoner ved PGT for enkeltgensykdommer (PGT-M) – markant økning i PGD for arvelig bryst- og eggstokkreftkreft.
Cirka to tredjedeler av analysene med PGD for monogen sykdom (PGT-M) var knyttet til autosomale dominante sykdommer (64 prosent), mens de resterende analysene fordelte seg på autosomale recessive (19 prosent) og X-bundne tilstander (18 prosent). Dette samsvarer med funn fra tidligere undersøkelser.
De mest vanlige indikasjonene for PGT-M var Huntingtons sykdom (9 prosent), arvelig bryst- og eggstokkreft type 1 (5,4 prosent), fragilt X-syndrom (5,3 prosent), myotonisk dystrofi type 1 (4,5 prosent) og cystisk fibrose (3,7 prosent). I tillegg ble Marfans syndrom, nevrofibromatose type 1, beta-thalassemi, Duchennes muskeldystrofi og Charcot-Marie-Tooths sykdom, type 1, også identifisert som hyppige indikasjoner.
Den mest markante økningen innen PGT-M gjelder testing for arvelig bryst- og eggstokkreft, sannsynligvis knyttet til patogene BRCA-varianter. I 2018 var dette den nest vanligste indikasjonen for PGT-M, til tross for at det i tidligere år ikke engang var blant de 15 mest rapporterte indikasjonene. nedenfor viser disse dataene.
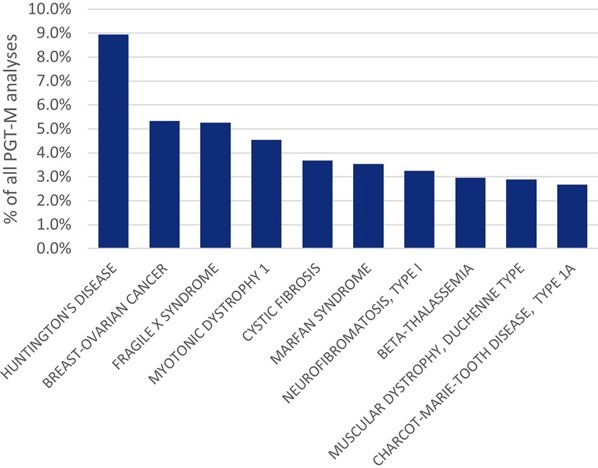
Forklaring til figuren: Figuren viser de ti vanligste indikasjonene for PGT-M rapportert i Europa i 2018. Gjengitt med tillatelse fra Spinella et al. (2023) [123.
Bruk og indikasjoner for PGT for aneuploidi (PGT-A)
PGT-A brukes om PGD for å analysere aneuploidi (ubalanse i kromosomtall) i embryo. Den vanligste indikasjonen for PGT-A var høy alder hos kvinnen (67 prosent), etterfulgt av gjentatte spontanaborter (8 prosent) gjentatt implantasjonssvikt (6 prosent), alvorlige mannlige faktorer (3 prosent), tidligere unormal graviditet (1,4 prosent) og eggdonasjon (1 prosent). I 8 prosent av analysene ble PGT-A utført uten en rapportert medisinsk indikasjon. Denne utviklingen beskrives som en trend som først ble observert i 2013, og som tilskrives bruken av PGT-A som et tilleggstilbud (add-on) i forbindelse med behandling innen assistert befruktning.
Bruk og indikasjoner for strukturelle kromosomavvik (PGT-SR)
PGT-SR brukes om PGD for å undersøke strukturelle kromosomavvik i embryo. Den vanligste indikasjonen for PGT-SR var resiproke translokasjoner (67 prosent). Dette kan oppstå når to kromosomer utveksler segmenter med hverandre. Personer som bærer en balansert translokasjon, hvor det ikke er tap eller tillegg av genetisk materiale, har vanligvis ingen symptomer, men kan ha økt risiko for infertilitet, spontanaborter, eller få barn med ubalanserte translokasjoner (som kan føre til alvorlige genetiske sykdommer).
Biopsi av embryo for å gjøre genetiske analyser
For å utføre genetisk testing på embryoer må det tas en liten celleprøve (biopsi). Det finnes tre hovedteknikker, som hovedsakelig skiller seg fra hverandre ved hvilket tidspunkt i embryoets utvikling prøven tas (ESHREs bruk av begrepene):
- Pollegemebiopsi: utføres på dag 0–1 (på ubefruktet eller nylig befruktet egg)
- Blastomerbiopsi: utføres på dag 3
- Trofektodermbiopsi: utføres på dag 5 til 6 (i del 1 av evalueringsrapporten bruker vi begrepet blastocyttbiopsi om biopsier som er tatt rundt dag 5 i utviklingen)
Data fra ESHRE viser en økende bruk av biopsier tatt på dag 5 til 6 (trofektodermbiopsi), spesielt i kombinasjon med omfattende helgenomsekvensering. Ved trofodermbiopsi tas celler fra trofektodermen – det ytre cellelaget som senere utvikler seg til morkaken – mens den indre cellemassen, som utvikler seg til fosteret, forblir urørt. Dette gir lavere risiko for skade på embryoet sammenlignet med blastomerbiopsi og gir tilgang til flere celler, noe som sikrer mer pålitelige analyseresultater.
En høy andel av embryoene er rapportert å ha celler med ulik kromosomsammensetning (mosaikk i embryo) [124]. Det betyr at noen celler har normale kromosomer, mens andre har kromosomfeil. Ved å teste flere celler, som ved trofektodermbiopsi, blir analyseresultatet mer representativt, og risikoen for feilaktige funn (falske positive) reduseres. Likevel kan mosaikk fortsatt gjøre tolkningen krevende.
ESHRE rapporterer at trofektodermbiopsi i økende grad kombineres med helgenomsekvensering, særlig ved:
- PGT-A (testing for kromosomavvik/aneuploidi)
- kombinert PGT-M/SR (testing for monogene sykdommer og strukturelle kromosomendringer)
Ved PGT-M og PGT-SR brukes også mer målrettede metoder som PCR (polymerasekjedereaksjon) og FISH (fluorescens in situ hybridisering), som fortsatt er utbredt i klinisk praksis.
Endringer i biopsi-metode og økt bruk av utvidet genetisk analyse, knyttes til økning i graviditeter. Graviditetsratene per embryooverføring har vært stabile for PGT-M og PGT-SR i perioden 2013–2018, med henholdsvis 34 til 35 prosent og 27 til 34 prosent. For PGT-A har det imidlertid vært en markant økning i samme periode, fra 47 prosent (2013–2015) til 55 prosent i 2018.
Denne forbedringen tilskrives særlig:
- økt bruk av trofektodermbiopsi
- mer omfattende genetisk testing
- økende bruk av fryse–tine-overføring (FET), som gir mer tid til analyse og bidrar til bedre timing for embryooverføring
ESHRE påpeker at ytterligere forbedringer i praksis, særlig innen PGT-M og PGT-SR, kan bidra til bedre kliniske resultater i årene som kommer.
[111] Skriftlig kommunikasjon med seniorrådgiver og lege Erik Iwarsson, Avdeling for klinisk genetikk, Karolinska Universitetssjukehus.
[112] Bekendtgørelse af lov om assisteret reproduktion i forbindelse med behandling, diagnostik og forskning m.v. (retsinformation.dk)
[113] Vejledning om sundhedspersoners og vævscentres virksomhed og forpligtelser i forbindelse med assisteret reproduktion (retsinformation.dk)
[116] Vejledning om sundhedspersoners og vævscentres virksomhed og forpligtelser i forbindelse med assisteret reproduktion (retsinformation.dk)
[117] Skriftlig innspill og data fra overlege Laura Roos ved Afdeling for genetik, Rigshospitalet. Data som vises i rapporten er gjengitt med tillatelse.
[120] Skriftlig kommunikasjon med Christel Hydén-Granskog, leder for PGT-teamet ved Helsingfors universitetssjukhus.
[121] Kristian Varden Gjerde, Ole-Bjørn Tysnes (2014) Genetisk sammenheng mellom amyotrofisk lateral sklerose og frontotemporal demens (tidsskriftet.no)
[122] Spinella F et al. (2023) ESHRE PGT Consortium data collection XXI: PGT analyses in 2018 (academic.oup.com). Human Reproduction Open. 2023 Apr 19;2023(2)
[123] Spinella F et al. (2023) ESHRE PGT Consortium data collection XXI: PGT analyses in 2018 (academic.oup.com). Human Reproduction Open. 2023 Apr 19;2023(2)
[124] Andel rapporterte embryo med mosaikk varierer avhengig av metode og for undersøkelse. Ved omfattende analyse av enkeltceller fra humane blastocyster fant Zhai et al. 2024 at 100 % av de analyserte embryoene viste tegn til mosaikk og at om lag ¼ av cellene i embryoet hadde aneuploidi. Dette antyder at mosaikk kan være mer utbredt enn tidligere antatt, spesielt når mer sensitive deteksjonsmetoder benyttes. Se Zhai, Fan et al. (2024) Human embryos harbor complex mosaicism with broad presence of aneuploid cells during early development (nature.com) Cell Discovery 10, 98 (2024)