Basalcellekarsinom
Kirurgi
Da tumor ofte er lokalisert i soleksponerte områder, spesielt i ansiktet, kan kirurgi med adekvate reseksjonsrender bli utfordrende. Residivfrekvens ved eksisjon av primær BCC er estimert til 4–10 %. Risikofaktorer for residiv er økt i ansiktets H-sone, ved aggressiv histologi og ved tumordiameter > 1 cm (se figur 22.3).
Pasienter med aggressiv histologi som infiltrerende-/morfeaforme /sklerodermiforme-/ mulitsentriske- og basosquamøs BCC har økende risiko for residiv: Ved disse histologiske subtypene bør Mohs (Roscher et al., 2011) kirurgi vurderes. På ala nasi og øret bør alltid bruskeksisjon (ev. m composit graft) vurderes. Ved residiver i og på nese, samt ytre øret, er reseksjonsrender på minimum 10 mm å anbefale, hvilket ofte krever mutilerende kirurgi.
I publikasjoner presenteres BCC som en type kreft uten spredningspotensiale, og metastasering angis som sjelden (< 0,1 %) (Breuninger et al., 1991). Lymfeknutediagnostikk er derfor kun aktuelt ved klinisk eller histologisk mistanke. BCC er ikke meldepliktig til Kreftregisteret.
Ad reseksjonsrender:
superficiell BCC: sikker fri reseksjonsrand
nodulær BCC: reseksjonsrand 3–5 mm
Infiltrativ/morfea/sklerodermiform/multisentrisk BCC: reseksjonsrand 10 mm
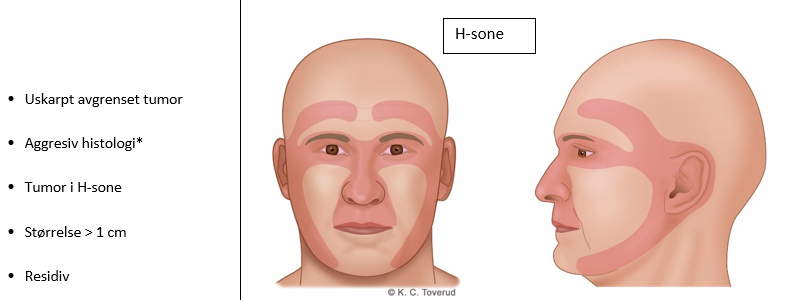
* Agressiv histologi = skleroserende, infiltrerende, mikronodulær, basosquamøs
Strålebehandling
BCC er relativt strålefølsomme, utfordringen er at 10 – 15 % av svulstene har et aggressivt, infiltrerende og/eller skleroserende vekstmønster og kan være vanskelig å avgrense klinisk. Disse sitter ofte i ansiktet og har høyere risiko for residiv enn andre former for basalcellekarsinomer (Telfer et al., 2008).
Det er 3 strålekvaliteter som er aktuelle for behandling av BCC:
- lavenergetisk røntgenstråling (50–150 kV)
- elektroner (6–20 MeV)
- høyenergetisk røntgenstråling (6, 10 og 15 MV)
Anvendelsen av lavenergetisk røntgenstråling begrenser seg til lesjoner tynnere enn 6 mm og egner seg best for superfisielle BCC. Disse kan imidlertid ha et betydelig areal og da er lavenergetisk røntgenstråling velegnet. Anbefalt CTV marginer er 10 mm for BCC < 2 cm, 13 mm for BCC > 2 cm (Khan et al., 2012). Fraksjonert bestråling gir vanligvis et godt kosmetisk resultat. For feltstørrelse < 4 cm brukes i Norge ofte 4 Gy x 12. For feltstørrelse 4 til 8 cm er 3 Gy x 17 et alternativ. For feltstørrelse > 8 cm anbefales reduksjon i fraksjonsdosen. Totaldosen bør ligge rundt 60 Gy (i 2 Gys ekvivalenter). Maksimal feltstørrelse er gjerne Ø = 15 cm. For energier lavere enn 12–14 MeV, må man bruke vevsekvivalent bolus for å få tilstrekkelig huddose. Bolus kan også brukes for å redusere dosen i dypet. Et mye brukt fraksjoneringsregime er 3 Gy x 18 = 54 Gy. RBE (Relativ Biologisk Effekt) av høyenergetiske elektroner ift. lavenergetisk røntgen er ca. 0.9 (Amols et al., 1986).
Lavenergetisk røntgenstråling tilbys ikke ved alle stråleeneheter i Norge (Stratigos et al., 2021).
Hvis man ikke kommer til målet med nevnte strålekvaliteter, vil ofte CT-doseplanlagt høyenergetisk røntgenstråling være løsningen.
Stråletoleransen kan variere mellom forskjellige anatomiske regioner. I hode-/halsregionen er den generelt god, men visse lokalisasjoner kan være vanskelig å behandle, f.eks. øvre øyelokk. Neseryggen, hvor tynn hud ligger på ben, er ofte preget av slitasje fra briller. Huden her er utsatt for stråleskader.
Medikamentell behandling
Kjemoterapi har en liten plass ved behandling av lokalavansert eller metastatisk BCC. Ulike kombinasjoner med blant annet cisplatin, doxorubicin og paclitaxel har vært gitt både neoadjuvant og adjuvant, men responsraten har vært lav (<30 %) og toksisiteten høy. Målrettet behandling mot epidermal vekstfaktorreseptor (EGFR) har vært forsøkt basert på studier som har vist høyt uttrykk av EGFR hos et utvalg pasienter med BCC. Ingen klinisk studier har klart å vise sikker nytte av behandling med EGFR antistoff (Ganti et al., 2011).
De siste årene har det kommet et nytt behandlingstilbud til pasienter med lokalavansert eller metastatisk BCC, hvor behandling med kirurgi eller stråling ikke er mulig.
Hedgehog-signalveien er en viktig signalvei i fosterlivet, som vanligvis er skrudd av hos voksne. Unntaket er i stamceller, hårfollikel- og hudceller hvor signaloverføring via blant annet PTCH bidrar til vedlikehold av cellevekst. PTCH-signalveien er overaktivert i over 90 % av pasientene med sporadisk oppstått BCC. Det er tilgjengelig perorale medikament som retter seg mot PTCH-signaloverføring (Cowey, 2013).
De første studiene som bekreftet effekt av Hedgehog-hemmer ved BCC ble publisert i 2009. Senere studier har vist behandlingseffekt hos 85–90 % av pasientene med lokalavansert BCC, noe lavere respons ved metastatisk sykdom (Von Hoff et al., 2009).
Selv om responsen er godt dokumenter stopper en del av pasientene behandlingen på grunn av bivirkninger, typisk er muskelkramper/smerter, tap av smak og appetitt, samt utvikling av alopeci (Sekulic et al., 2012).
Nylig ble PD-L1 hemmeren cemiplimab godkjent for bruk hos pasienter med BCC hvor Hegdhog- hemmer ikke har effekt eller bivirkningene er intolerable (Sekretariatet for nye metoder, 2022).
Prognose
Metastaseringsfrekvens vurderes som lavere enn 0,1 %, mens lokalt residiv ved «vanlig» exisjon estimeres til 4–10 %. Henviser til 22.7.1.1 mht. lokalisasjon, histologiske subtyper og anbefalte reseksjonsrender.
Plateepitelkarsinom
Kirurgi
Med samme etiologi og lokalisasjon som BCC, vil de samme kirurgiske utfordringer som ved BCC foreligge, men kravene til reseksjonsrender er skjerpet. Kirurgisk fri reseksjonsrand bør være 8–10 mm (Kolk et al., 2014). Risiko for metastasering av PEC i hode/hals-området estimeres til ca. 5 %. Unntak er ytre øret og vestibulum nasi hvor tumor allerede tidlig kan infiltrere pericondrium og brusk. Her kreves vid reseksjon, hvilket i praksis bør innbefatte pericondrium og brusk. Dette er for lokalisasjon på øret vist å redusere risiko for lokalt residiv fra 30 % til <10 % (Breuninger et al., 1991). Et annet risikoområde er hud på cutane leppe, hvor stor tendens til residiv og aggresiv vekst beskrives.
High-risk PEC defineres i tillegg til nevnte lokalisasjoner (vestibulum nasi, øre, cutane leppe), utfra tumorstørrelse (> 2 cm), tumordybde (> 2 mm), recurrent tumor, ulcerasjon, høy mitotisk index (under kapitel om patologi) og perinevral vekst. High-risk PEC vil ha økende tendens til lokalt residiv og regional metastasering. NCCN oppgraderer klassifikasjon av T≥ 2 cm til Stage II dersom de viser 2 av risiko-faktorene nevnt ovenfor.
Anbefalte reseksjonsrender (NCCN) for high-risk-PEC i henhold til «site» i hud hode/hals:
> 10 mm for hake, panne, skalp og hals
> 6 mm for «the mask areas» av ansiktet.
Kompletterende kirurgi vil være avhengig av stadium, histologi og reseksjonsrender. Modifisert HLD vurderes i henhold til primærtumors lokalisering:
Nese/vestibulum nasi/kinn: metastaserer til submandibulære glandler
Leppe: submentale glandler
Ytre øret: posteriore auriculære gl. og regio parotideus (spes øvre del av helix)
Posteriore skalp: occipitale glandler
Regio frontalis, temporalis og ytre øret: regio parotideus/parotis.
er utvidet HLD (spes regio II og III) må vurderes. Indikasjon for SLNB for high-risk PEC er ennå under diskusjon (Govers et al., 2013), også ifølge UpToDate.
T1 | Generelt 8 mm fri kirurgisk kirurgisk rand. Uten high-risk faktorer ingen tilleggsbehandling. |
|---|---|
T2 | High-risk før primær kirurgi, dvs. site/ulcerasjon/aggressivt vekstmønster: CT/MR før kirurgi. 10 mm fri rand. Elektiv HLD vurderes. Selektiv HLD ved N+. |
(cT1 | Med 2 high-risk faktorer etter primær kirurgi: Tumor omklassifiseres til pT2 og det gjøres MR/CT før utvidet reseksjon 10 mm og elektiv HLD vurderes. Selektiv HLD ved N+). |
T3 | 10 mm sikker reseksjonsrand og HLD, og utifra størrelse blir hudlapp oftest nødvendig |
T4 | Som T3, med ev. supplerende kirurgi i tilstøtende ekstradermalt vev |
(Tabell laget av handlingsprogramgruppen).
Residiv bør behandles som høyrisiko-kreft. Mohs kirurgi ved primærtumor T2 eller større bør vurderes.
Pericondriet skal alltid med til histologi fra vestibulum nasi og ytre øret, og hvis affeksjon tilrådes utvidet reseksjon inkusive brusk.
Prognose i henhold til kirurgisk primærbehandling: Det er estimert en metastasefrekvens på 5 %, men dette synes som et usikkert estimat. Risikolokalisasjoner er presisert (23.7.2.1), og lokale residiver er svært avhengig av at anbefalte reseksjonsrender følges.
Strålebehandling
PEC er vanligvis strålefølsomme. Anbefalt CTV-marginer er 11 mm for PEC < 2 cm, 14 mm for PEC > 2 cm (Khan et al., 2012).
Medikamentell behandling
Som ved PEC i hode/hals-slimhinner, har konkomitant radiokjemoterapi også vært forsøkt ved behandling av PEC i hud. Aktuelle regimer har vært cisplatin/5FU, cisplatin ukentlig eller hver tredje uke, samt cetuximab. Responser er beskrevet. Ved å ekstrapolere resultatene fra PEC i hode/ hals-regionen, kan postoperativ konkomitant radiokjemoterapi med cisplatin ved multiple lymfeknutemetastaser, lymfeknutemetastase > 3 cm, bløtvevsinfiltrasjon, ekstrakapsulær vekst og perinevral infiltrasjon i henhold til NCCN guidelines. Det er imidlertid ingen studier som bekrefter nytten (DeConti, 2012).
Cemiplimab ble 19.01.2026 godkjent for bruk i adjuvant situasjon for høy-risiko plateepitelcarsinomer i hud etter kirurgi og strålebehandling (Cemiplimab (Libtayo) (nyemetoder.no)) Beslutningen bygger blant annet på C-Post studien (Rischin et al., 2025). Studien viste bedre 2-års sykdomsfri overlevelse for pasientene som fikk Cemiplimab (87,1%) sammenliknet med placebo (64,1%), men mer toksisitet 9,8% vs 1,5% (Rischin et al., 2025).
Denne behandlingen er aktuelt for pasienter som er operert og har mottatt postoperativ strålebehandling med total dose ≥ 50Gy, som er i god allmenntilstand (ECOG 0-1).
Høy risiko var i studien definert som:
- lymfeknutemetastaser med perinodal vekst, hvor minst én av lymfeknutene var større enn 2 cm i diameter, eller som tre eller flere lymfeknutemetastaser, uavhengig av perinodal vekst.
- T4 primær svulster (med beninnvekst), in transit metastaser, radiologisk eller klinisk påvist perineural vekst.
- Tilbakefall med én eller flere av følgende risikofaktorer: primær tumor ≥T3, lymfeknutemetastaser ≥N2b, lavt differensiert karsinom som måler ≥20 mm i diameter.
Ved tilbakefall eller metastatisk PEC er immunterapi med PD1 antistoff en godkjent og tilgjengelig behandling. Effekten er dokumentert i en fase II studie (Migden et al., 2018) og bivirkningene har vist seg å være tolerable – på tross av at pasienter med PEC ofte er eldre og kan ha betydelig komorbiditet. Bruken av immunterapi neoadjuvant (før kirurgi eller stråling) er under utprøving (Hughes et al., 2021; Merck Sharp & Dohme LLC, 2017-2023).
Overekspresjon av EGFR er vist å være en uavhengig negativ prognostisk variabel ved metastatisk PEC i hud. Målrettet behandling mot EGFR har vært forsøkt ved PEC som har vist høyt uttrykk av EGFR. I en fase II studie behandlet Maubec og medarbeidere 36 pasienter med inoperabel PEC i hud med cetuximab i første linje. Sykdomskontroll etter 6 uker var 25 av 36 (69 %), hvorav 8 partielle og 2 komplette responser. Angående bivirkninger så fikk 78 % av pasientene akne liknende utslett grad 1–2. To pasienter fikk infusjonreaksjon grad 4 og 1 pasient pneumonitt grad 3 (Maubec et al., 2011). Cetuximab er mye brukt hos nyretransplanterte og immunsupprimerte pasienter med PEC.
Kjemoterapi har en usikker plass ved behandling av lokalavansert eller metastatisk PEC. Ulike kombinasjoner med blant annet cisplatin/ doxorubicin, karboplatin/paclitaxel og cisplatin/capecitabine har vært gitt både neoadjuvant, adjuvant og ved metastatisk sykdom. Det foreligger imidlertid ingen større prospektive studier. Studiene har gjerne vært små og med variable responsrater. Komplette responser er beskrevet.
Melanom
For behandling av melanom med utgangspunkt i hud vises det til Nasjonalt handlingsprogram for melanomer: Melanomer – handlingsprogram - Helsedirektoratet.
Nasjonalt handlingsprogram med retningslinjer for melanom er inngående og detaljert, og legges til grunn innen hode- og halskreft. Hode-halskirurger blir særlig involvert ved metastaser til lymfeknuter i hode og hals.
Merkelcellekarsinom
Kirurgi
Kirurgi med vide reseksjonsrender er nødvendig, avhengig av tumor størrelse og lokalisasjon. Det tilrådes i de fleste artikler en fri reseksjonsrand på > 20 mm, og SN synes å være viktig for diagnose og valg av behandling.
Ved bekreftet Merkelcellekarsinom anbefales CT/MR med tanke på regional spredning og mulige fjernmetastaser. PET bør vurderes før eventuell vid eksisjon med minimum 20 mm marginer og SN. Mohs mikrokirurgi kan vurderes. Elektiv eller selektiv HLD vurderes i henhold til histologisk subtype, bildeundersøkelse og SN (Nyrud et al., 2022; Wong et al., 2012).
Store reseksjoner i hode og hals bør gjøres i samarbeide med plastikk-kirurg, og postoperativ strålebehandling vurderes i tverrfaglig team.
Algoritme for klassifisering av MCC (TNM 8 AJCC/UICC) (American Cancer Society, 2018):
- Stadium I T<2 cm, N0M0
- Stadium II T > 2 cm, eller infiltrasjon i annet vev enn hud.
- Stadium III Alle T-stadier med N+.
- Stadium IV Alle T-stadier med fjernmetastase.
Strålebehandling
Merkelcellekarsinomer er strålesensitive, og strålebehandling står sentralt i håndtering av sykdommen. Strålebehandling kan gis som eneste behandling hos inoperable pasienter eller adjuvant til operasjon. Selv etter vide lokale eksisjoner, anbefales postoperativ strålebehandling. Aktuelle regioner for strålebehandling er tumorseng og regionale lymfeknuter med tilførende lymfebaner. Strålebehandling mot tumorseng har vist å redusere sjansen for lokalt residiv 3–4 ganger. Hva gjelder stråledose, anses 50 Gy tilstrekkelig for subklinisk sykdom, 60–70 Gy ved mikroskopisk og/eller makroskopisk restsykdom (Halperin et al., 2013; Wang et al., 2011).
Medikamentell behandling
Selv om Merkelcellekarsinom ofte responderer bra på kjemoterapi, så er dens rolle noe uavklart i primærbehandling. Ved lokalavansert sykdom og/eller fjernmetastaser kan det imidlertid være aktuelt å gi kjemoterapi med palliasjon som siktemål. Vanligste medikamenter er cisplatin, etoposid (PV), doxorubicin, epirubicin, cyclofofamid og vincristin (ACO/ECO), ikke ulikt behandling av småcellet lungekarsinom (Nicolaidou et al., 2012).
Avelumab (PD1-L1 antistoff) har vist seg å være effektivt (Kaufman et al., 2016) og er i Norge godkjent brukt som 2. linjes palliativ behandling.
Prognose
MCC er en aggressiv nevroendokrin tumor i hud med høyt metastaseringspotensiale. Fem års mortalitetsrate er angitt å være 46 % (Clark et al., 2010), mens Kolk et al. rapporterer median survival på 33 mnd. (median alder 70 år). Insidensen av MCC er økende (Kolk et al., 2014).