2. Joint Committee on Infant Hearing.
Year 2007 position statement: Principles and guidelines for early hearing detection and intervention programs. The Journal of Pediatrics. 2007. 120. 898-921.
13. Korres, SG, Balatsouras, DG, Lyra, C, Kandiloros, D, Ferekidis, E.
A comparison of automated auditory brainstem response and transiently evoked otoacoustic emissions for universal newborn hearing screening. International Medical Journal of Experimental and Clinical Research. 2006. 12. 6. Cr260-Cr263.
15. Yoshinaga-Itano, C.
Principles and guidelines for early intervention after confirmation that a child is deaf or hard of hearing. Journal of Deaf Studies and Deaf Education. 2014. 19. 2. 143-175.
16. Council tAHMA.
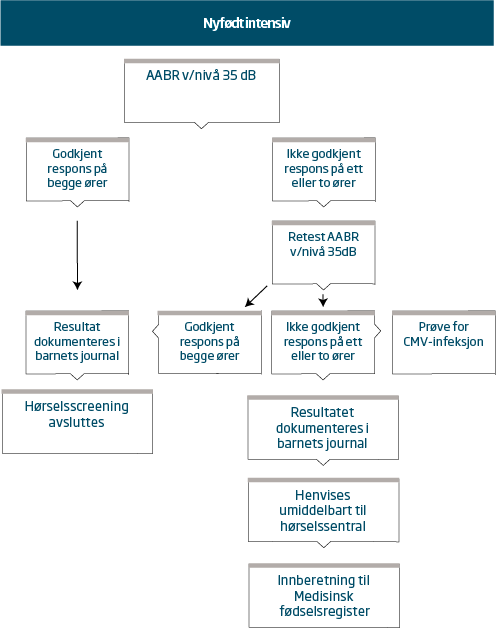
National Framework for Neonatal Hearing Screening. CCaPHPCotAHMACiA. 2013. page 53.
23. Korver, AM, Konings, S, Meuwese-Jongejeugd, A, van Straaten, HL, Uilenburg, N, Dekker, FW.
National study of newborn hearing screening: programme sensitivity and characteristics of undetected children. B-ent. 2013. Suppl 21. 37-44.
29. Nelson, HD, Bougatsos, C, Nygren, P.
Universal Newborn Hearing Screening: Systematic Review to Update the 2001 US Preventive Services Task Force Recommendations. The Journal of Pediatrics. 2008. 122. 1. e266-e276.
30. Tewfik, TL, Dorion, D.
European Consensus Statement on Neonatal Hearing Screening. Finalised at the European Consensus development Conference on Neonatal Heaing Screening 15 - 16 May 1998, Milan. The Journal of Otolarongology. 199. 28. 1. 1-2.
34. Vlastarakos, PV, Nikolopoulos, TP, Tavoulari, E, Papacharalambous, G, Korres, S.
Auditory neuropathy: endo cochlear lesion or temporal processing impairment? Implications for diagnosis and management. International Journal of Paediatric Otorhinolaryngology. 2008. 72. 8. 1135-1150.
35. Rance, G, Ryan MM, Carew, P, corben, LA, Yiu, E, Tan, J et al.
Binaural speech processing in individuals with auditory neuropathy. The Journal of Neuroscience. 2012. 226. 227-235.
36. Tomlin, D, Rance, G.
Long-term hearing deficits after childhood middle ear disease. Ear and Hearing. 2014. 35. 6. e233-e242.
37. Doyle, KJ, Sininger, Y, Starr, A.
Auditory neuropathy in childhood. The Laryngoscope. 1998. 108. 9. 1374-1377.
38. Manchaiah, VK, Zhao, F, Danesh, AA, Duprey, R.
The genetic basis of auditory neuropathy spectrum disorder (ANSD). International Journal of Pediatric Otorhinolaryngology. 2011. 75. 2. 151-158.
39. Silva, D, Lopez, P, Mantovani, JC.
Auditory brainstem response in term and preterm infants with neonatal complications: the importance of sequential evaluation. International Archives of Otorhinolaryngology. 2015. 19. 2. 161-165.
40. Thornton, AR, Kimm, L, Kennedy, CR.
Methodological factors in neonatal screening using transient-evoked otoacustic emissions and automated auditory brainstem response testing. Hearing Research. 2003. 182. 1-2. 65-76.
41. Sanyelbhaa Talaat, H, Kabel, AH, Samy, H, Elbadry, M.
Prevalence of auditory neuropathy (AN) among infants and young children with severe to profound hearing loss. International Journal of Pediatric Otorhinolaryngology. 2009. 73. 7. 937-939.
42. Rance, G.
Auditory neuropathy/dys-synchrony and its perceptual consequences. Trends in Amplification. 2005. 9. 1. 1-43.
43. Korver, AM, van Zanten, GA, Meuwese-Jongejeugd, A, van Straaten, HL, Oudesluys-Murphy, AM.
Auditory neuropathy in a low risk population: a review of the literature. International Journal of Pediatric Otorhinolaryngology. 2012. 76. 12. 1708-1711.
44. Bielecki, I, Horbulewicz, A, Wolan, T,.
Prevalence and risk factors for auditory neuropathy spectrum disorder. International Journal of Pediatric Otorhinolaryngology. 2012. 76. 11. 1668-1670.
45. Coenraad, S, Goedegebure, A, van Goudoever, JB, Hoeve, LJ.
Risk factors for auditory neuropathyspectrum disorder in NICU infants compared to normal-hearing NICU controls. The Laryngoscope. 2011. 121. 4. 852-855.
46. Colella-Santos, MF, Hein, TA, de Souza, GL, do Amaral, MI, Casali, RL.
Newborn hearing screening and early diagnostic in the NICU. BioMed Research International. 2014. Article ID 845308.
47. Dowley, AC, Whitehouse, WP, Mason, SM, Cope, Y, Grant, J, Gibbin, KP.
Auditory neuropathy: unexpectedly common in a screened newborn population. Developmental Medicine an Child Neurology. 2009. 51. 8. 642-646.
48. Maris, M, Venstermans, C, Boudewyns, AN.
Auditory neuropathy/dyssynchrony as a cause of failed neonatal hearing screening. International Journal of Pediatric Otorhinolaryngology. 2011. 75. 7. 973-975.