Medikamentell behandling av ikke-operabel sykdom har som mål å forlenge levetid, lindre symptomer og opprettholde livskvalitet (Sorbye et al., 2009).
Behandlingsstrategien vil avhenge av hvorvidt det er ønskelig med rask respons på grunn av symptomer (Van Cutsem et al., 2016), eller om behandlingen først og fremst har som mål å hindre videre progresjon og gi forlenget levetid. Dersom rask respons er ønskelig anbefales kombinasjonskjemoterapi gitt som infusjonsregimer sammen med antistoff. Ved mindre intensiv behandling kan en starte med monoterapi for senere å gi kombinasjonsbehandling (Ducreux et al., 2011; Gramont Lesparre et al., 2009; Koopman et al., 2007; Seymour et al., 2007). Oppstart av behandling kan eventuelt avventes hvis sykdommen har liten tumorbyrde og langsom vekst, for eksempel ved få og små lungemetastaser.
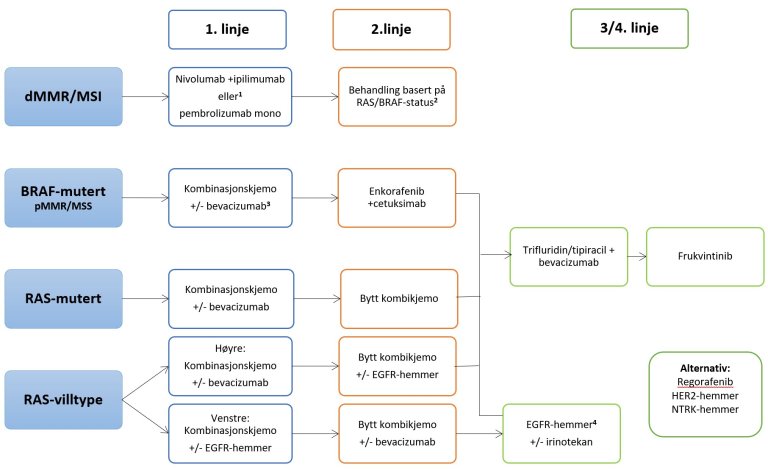
Medikamentell behandlingsalgoritme ved metastatisk kolorektal cancer
Last ned behandlingsalgoritmen som PDF
Kombinasjonskjemo betyr fluouracil/5FU i kombinasjon med oksaliplatin eller irinotekan. Vanlige regimer er: Folfox, Flox, Capox, Folfiri, Fliri. Ved lite sykdomsbyrde kan det i førstelinje gis monoterapi 5FU og bytte til kombinasjonskjemo ved progresjon. Hos skrøpelige/eldre bør kjemoterapi gis i redusert dose.
1Dobbel immunterapi i førstelinje gir best effekt, monoterapi velges når dobbel-behandling ikke er aktuelt pga. bivirkninger eller antatt toleranse.
2Dersom immunterapi ikke er aktuelt eller ved progress, velges behandling basert på RAS/BRAF-status skissert under.
3Enkorafenib/cetuksimab/Folfox basert på Breakwater-studien har best effekt i førstelinje, men er ennå ikke godkjent som standardbehandling i Norge. Kan vurderes hos enkeltpasienter der førstelinjes kjemoterapi ikke er aktuelt.
4EGFR-hemmer vurderes dersom ikke gitt tidligere eller som reintroduksjon dersom gitt i førstelinje.
For aktuelle medikamenter og bivirkninger, se vedlegg (kapittel 20.3)