Ved klinisk mistanke om hjernesvulst er det sterk indikasjon for rask bildediagnostisk utredning. For korrekt prioritering og valg av protokoll må henvisningen til bildediagnostikk inneholde informasjon om mistanken om hjernesvulst og relevante opplysninger om symptomer, nevrologiske funn og hastighet av symptomutviklingen. Den viktigste bildemetoden er magnetisk resonans bildedanning (MR) og skal gjennomføres på alle pasienter hvor man mistenker hjernesvulst (såfremt det ikke foreligger kontraindikasjoner). Formålet med undersøkelsen er å bekrefte eller avkrefte svulstmistanken. Påvises svulst skal beskrivelsen gi informasjon om lokalisasjon, utbredelse og utseende, samt differensialdiagnostiske vurderinger om svulsttype. Ved kontroller skal undersøkelsen gi opplysninger om eventuelle komplikasjoner og restsvulst etter kirurgi, og effekt av kjemoterapi og strålebehandling. Det er viktig at man i henvisningen til MR opplyser hvilken tumorrettet intervensjon som er gitt og hvilke tidligere undersøkelser man ønsker at bildene skal sammenlignes med. Eventuell steroidbruk bør også presiseres i henvisningen. Radiolog må sørge for å sammenligne med relevante tidligere undersøkelser, spesielt bilder gjort tidlig postoperativt (baseline-bilder). Spesielt er dette viktig hos pasienter med saktevoksende svulster, hvor endring over tid ofte ikke erkjennes hvis man kun sammenligner med forrige kontroll og ikke med baseline-bilder.
MR-undersøkelse
MR er den klart viktigste bildemetoden både i primærutredning og ved kontroller av hjernesvulster. Pasienter med mistanke om hjernesvulst er en høyt prioritert gruppe som skal ha rask tilgang på MR-diagnostikk. En MR-undersøkelse består nesten alltid av flere MR-sekvenser som framstiller vevet på ulike måter, og sekvensene blir gjerne tatt i forskjellige bildeplan (Bitar et al., 2006; Castillo, 2014; Mabray et al., 2015; Mikulis et al., 2007; Roberts et al., 2007). Ved norske sykehus er det MR-utstyr fra ulike produsenter og med varierende alder, kvalitet og tekniske muligheter. Det er derfor ofte nødvendig med lokale tilpasninger av undersøkelsesprotokollene. Hvis mulig bør pasienten undersøkes på samme maskin ved de ulike MR-kontrollene for best mulig å kunne sammenligne undersøkelser med hverandre (Ellingson et al., 2015).
Sekvens | Bildeplan |
T1 før kontrast | 3D |
TSE/FSE T2 | Transversal |
FLAIR | 3D |
Diffusjon | Transversal |
T1 etter intravenøs kontrast | 3D |
T2-vektede sekvenser
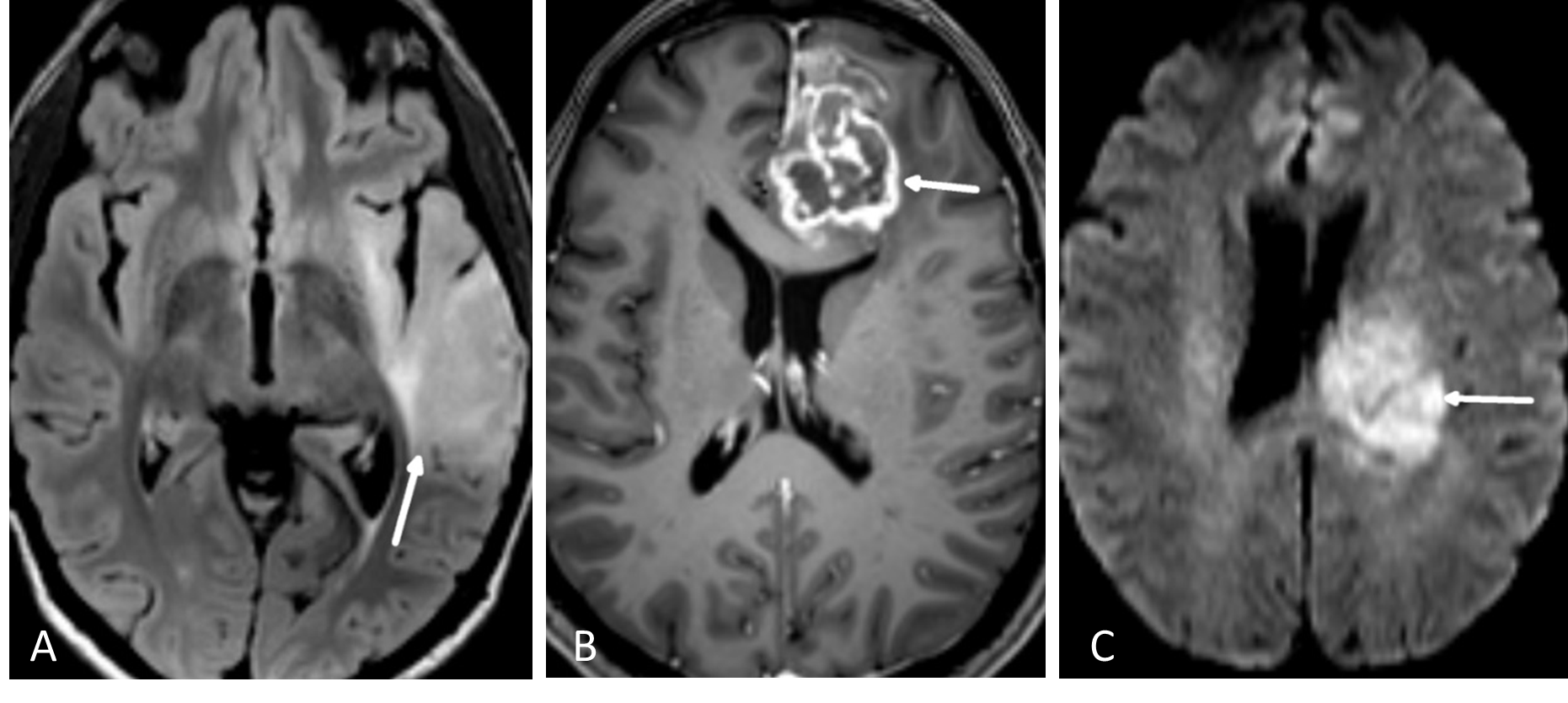
På T2-vektede sekvenser vil cerebrospinalvæsken være lys, mens hvit hjernesubstans vil være litt mørkere enn grå substans. Siden nesten all patologi i hjernen som tumor, infarkt og inflammasjon medfører økt mengde vann i vevet, vil patologi som en hovedregel lyse opp, altså ha høyt signal, på T2-bilder. Den mest brukte T2-sekvensen i hjernen heter turbo (eller fast) spin ekko (TSE-T2). En tumorprotokoll vil nesten alltid inkludere en T2-sekvens i transversalplan.
FLAIR
FLAIR er en MR-teknikk hvor man har eliminert det lyse signalet fra cerebrospinalvæsken i en T2-vektet bildesekvens (Figur 5.1). Man kan tro at når signalet i cerebrospinalvæsken undertrykkes blir også vann i en tumor svart. Det er imidlertid forskjell på MR-egenskapene til såkalt fritt vann (som i cerebrospinalvæske) og såkalt bundet vann som interagerer med blant annet makromolekyler i cellemembraner (som i en tumor). FLAIR-sekvensen er laget slik at det bare er det frie vannet som undertrykkes, mens bundet vann i patologiske lesjoner fortsatt lyser opp. En hjernetumorprotokoll vil alltid inneholde en FLAIR-sekvens, vanligvis som et 3D-volum som kan rekonstrueres i valgfrie bildeplan. Særlig på lavgradige, diffust infiltrerende svulster er FLAIR den mest sensitive bildesekvensen.
T1-vektede sekvenser
På T1-vektede MR-bilder av hjernen er cerebrospinalvæsken svart, fett i benmarg og underhud er lyst, mens hvit hjernesubstans er lysere enn grå substans. De mest brukte MR- kontrastmidler er gadolinium-chelater som gis intravenøst. Vev som tar opp kontrastmidlet får høyere signal (blir lyst) på kontrastforsterkede T1-bilder. MR-kontrastmidler krysser ikke en intakt blod-hjerne-barriere. Høygradig maligne hjernesvulster (CNS WHO grad 3-4), metastaser og meningeomer vil som regel lade opp kontrast, mens lavgradige nevroepiteliale svulster (CNS WHO grad 1-2) ofte ikke har kontrastopptak (Figur 5.1). Det er dog ingen absolutt sammenheng mellom kontrastopptak og graden av aggressivitet i svulsten. Alle tumorprotokoller inneholder T1-sekvenser før og etter intravenøs kontrast, enten som bildeopptak i transversal- og koronalplan, eller som et 3D-volumopptak som rekonstrueres i valgfrie bildeplan. Det sistnevnte er nå det vanligste. Det er et viktig poeng at ikke alt som lyser opp på T1-bilder er kontrastopptak, for eksempel har også blod og fett høyt T1-signal. For å unngå feiltolkning inneholder derfor tumorprotokollen også en T1-serie før kontrastinjeksjon.
Diffusjonssekvenser
Bildekontrasten på diffusjonsbilder avhenger av vannmolekylenes mobilitet i vevet. Mobiliteten til vannmolekylene er høy i rommet mellom cellene, men lav inne i cellene. Hjernesvulster med høy celletetthet som lymfomer og medulloblastomer, har lav diffusjon. Høygradige gliomer (CNS WHO grad 3 og 4) har høyere celletetthet og dermed lavere diffusjon enn gliomer med lavere malignitetsgrad (Figur 5.1). Diffusjonsvektede bilder er også nyttige for å skille mellom nekrose og abscesser.
Avanserte MR-teknikker som brukes i hjernesvulstdiagnostikk
Av og til oppnår man ikke tilstrekkelig diagnostisk avklaring med en MR-basisprotokoll som beskrevet over. I primærutredningen vil det ofte være differensialdiagnostiske avveininger hvorvidt et bildefunn faktisk representerer neoplastisk vev, eller om funnet representerer andre patologiske prosesser som for eksempel infeksjon, inflammasjon eller sirkulasjonsforstyrrelser. Eksempler på vanskelige bildediagnostiske problemstillinger ved oppfølging av pasienter med hjernesvulst, er differensiering mellom sykdomsprogresjon og strålenekrose, samt vurdering av om det kan foreligge malign transformasjon ved diffuse CNS WHO grad 2 gliomer. I slike tilfeller kan det være nødvendig å benytte mer avanserte MR-metoder for å oppnå en sikrere diagnose (Majos et al., 2009; Svolos et al., 2014). Dette er metoder som er tilgjengelige på alle universitetssykehus og på mange av de andre større sykehusene.
Diffusjon tensor imaging (DTI)
DTI er en videreutvikling av diffusjonsteknikken hvor man ser på retningsbestemt vannbevegelse i hjernevevet. Siden vannmolekylene beveger seg lettere langs nervecellenes aksoner i hvit substans enn på tvers, kan retningen av aksonbanene kartlegges. Dette er en metode som i svulstdiagnostikken særlig blir brukt for å kartlegge forløpet av viktige baner som pyramidebanene eller synsbanene før kirurgiske inngrep.
MR-perfusjon
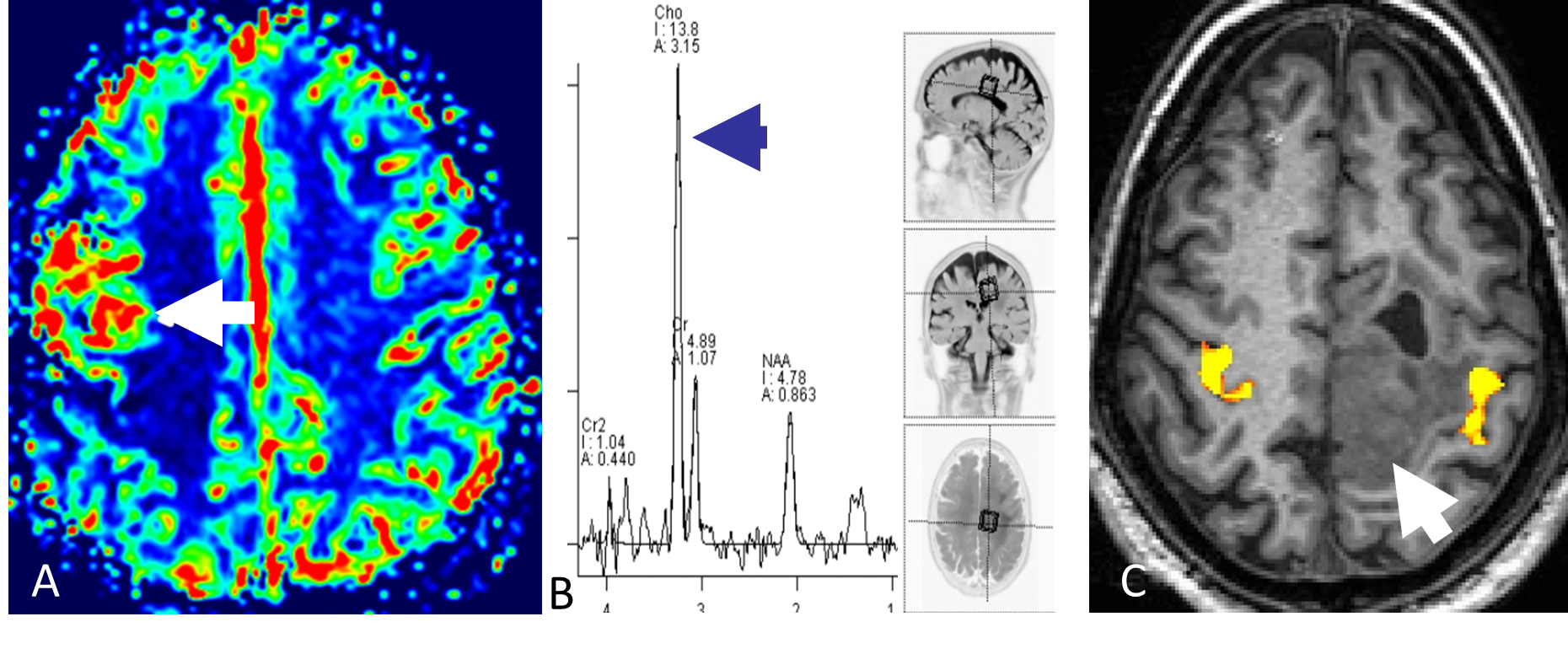
Ved å gi en rask intravenøs injeksjon med kontrastmiddel og deretter følge kontrastens passasje gjennom kapillærsirkulasjonen i hjernen, kan man ved MR-perfusjon få informasjon om variabler som blodvolum og blodperfusjon i hjernevev og tumor. Høygradig maligne svulster har typisk mange og store tumorkar og har derfor høyere blodvolum og perfusjon enn lavgradige svulster (Figur 5.2). MR-perfusjon kan videre differensiere svulster fra andre tilstander, for eksempel vil strålenekrose oftest ha lavt blodvolum og lav blodperfusjon (Mabray et al., 2015).
MR-spektroskopi (MRS)
MRS gir informasjon om biokjemiske forhold i hjerneparenchymet. Hydrogenkjerner har litt ulike MR-egenskaper avhengig av hvilket molekyl de er bundet til. Ved MRS brukes disse små forskjellene til å lage et spekter hvor toppene representerer ulike metabolitter og størrelsen på toppene indikerer konsentrasjonen i vevet. Ved en rekke tilstander endres vevets biokjemi; i maligne svulster øker for eksempel mengden av metabolitten cholin (Figur 5.2) (Mabray et al., 2015). Diagnostisk benyttes metoden særlig til å differensiere mellom ulike hjernesvulster og for å skille mellom tumor og annen type patologi.
BOLD fMRI
BOLD fMRI er en MR-metode som benyttes til kartlegging av hjerneaktivitet. I klinisk sammenheng benyttes BOLD fMRI særlig til å kartlegge viktige kortikale områder før kirurgisk behandling av hjernesvulster (Figur 5.2). Metoden har dessuten fått svært stor betydning i nevrovitenskapen for å øke forståelsen av hjernens funksjoner.
Ulemper og kontraindikasjoner ved MR
MR-undersøkelser tar tid, en hjerneundersøkelse varer typisk 20–40 minutter. For små barn er dette et problem og undersøkelse i narkose er ofte nødvendig. Dessverre kan ikke alle pasienter undersøkes med MR. Både drag fra magnetfeltet og varmeutvikling fra radiofrekvenspulsene kan skape farlige situasjoner hos pasienter med ulike typer implantater. De siste årene har svært mange implantater gjennomgått teknologiske endringer slik at de fleste pasienter med nyere modeller av pacemaker, ICD (defibrillator), nervestimulator, hjernestimulator, shuntventiler, med videre nå kan undersøkes med MR. Ofte må man ta spesielle forholdsregler før undersøkelsen, for eksempel må pacemaker og ICD stilles inn på MR-modus, dette krever samarbeid med kardiolog. Ved VP-shunt med justerbar ventil er kontroll av innstilling oftest nødvendig etter MR. Det er svært viktig at henviser i henvisning til MR opplyser tydelig hvis pasienten har denne type implantater slik at nødvendige forsiktighetsregler kan følges. Ferromagnetiske gjenstander som enkelte typer eldre cerebrale aneurysmeklips og metallfremmedlegemer vil fortsatt være kontraindikasjon for MR.
CT
CT er ved de fleste sykehus en lett tilgjengelig bildemetode. Dagens CT-maskiner er av multidetektor type (MDCT) som kan ta volumopptak ved at bordet som pasienten ligger på beveger seg gjennom maskinen mens røntgenrøret roterer kontinuerlig. For hver rotasjon av røntgenrøret tas mange snitt og bildeopptaket kan derfor gå svært raskt, et volumopptak av hodet vil typisk ta omtrent 10 sekunder. En ulempe med CT er at bløtdelskontrasten i hjerne og ryggmarg er dårligere enn på MR, og det medfører at det er vanskeligere å se svulster på CT. Særlig diffust infiltrerende hjernesvulster, svulster som ikke tar opp intravenøs kontrast og svulster i bakre skallegrop kan overses på CT. Undersøkelsen er derfor ikke egnet som primærundersøkelse ved klinisk mistanke om svulst. Unntaket er akutte tilfeller som nyoppståtte epileptiske anfall eller kliniske tegn på høyt intrakranielt trykk, hvor CT kan avklare om det er blødning eller andre forhold som krever akutt intervensjon. CT-undersøkelser gir strålebelastning som man må ta hensyn til, særlig hos unge pasienter og pasienter som har behov for gjentatte kontroller (se kapittel Forebygging). CT er derfor lite egnet til kontrollundersøkelser hos hjernesvulstpasienter og brukes i praksis bare når det foreligger kontraindikasjoner for MR. En CT caput-undersøkelse vil typisk gi en stråledose på 2.0 mSv. Til sammenlikning er gjennomsnittlig bakgrunnsstråling i Norge 3–4 mSv/år.
Nukleærmedisinsk bildediagnostikk
Nukleærmedisin er bruk av radioaktivt merkede sporstoff for diagnostikk eller behandling (Verger et al., 2022). Det mest brukte sporstoff – som er tilgjengelig på stort sett alle nukleærmedisinske enheter i Norge – er [18F]-merket fluordeoxyglukose ([18F]FDG). Dette sporstoffet utnytter at glukoseopptak er oppregulert i de fleste solide maligne svulster, for eksempel lungecancer, kolorektalcancer og lymfomer. Hjernesvulster med høyt [18F]FDG-opptak er hovedsakelig høygradige gliomer, hjernemetastaser og lymfomer. Lavgradige gliomer har ikke økt opptak av [18F]FDG.
Derimot har de aller fleste gliomer økt opptak av radioaktive aminosyrer. De mest brukte aminosyre-tracerne er [11C]metionin (kun ved Haukeland universitetssjukehus), [18F]fluoroethyltyrosin ([18F]FET) (ikke tilgjengelig i Norge), og [18F]dihydroxyphenylalanine ([18F]DOPA (kun ved Haukeland universitetssjukehus). I tillegg har [18F]fluciclovine vært brukt tidligere (Oslo universitetssykehus) (Albano et al., 2020; Karlberg et al., 2019). Fordelen med aminosyre-PET er at det ses opptak kun i malignt vev, men i kun liten grad i normalt hjernevev. Det er derfor en stor fordel om undersøkelsen tas på en hybrid PET/MR skanner der pasienten kan få utført både PET-opptak og MR av hjernen (også med intravenøs kontrast) i én seanse. Aminosyre-PET brukes mest for å skille tumorresidiv fra stråleinduserte forandringer og kan også brukes for å kartlegge behandlingsrespons (Law et al., 2019). Den kan også supplere primærdiagnostikk med MR dersom diagnosen er usikker eller man vil finne best egnede sted for hjernebiopsi (Dontala et al., Under publisering 2024).
Nesten alle meningeomer uttrykker somatostatin-reseptorer. For avbildning av meningeomer kan man derfor bruke sporstoffet [68Ga]DOTATOC eller analoger til dette (Dontala et al., Under publisering 2024).
Retningslinjer for tekniske aspekter ved bruk av PET-tracere er utgitt av internasjonale nukleærmedisinske foreninger i samarbeid med nevroonkologiske foreninger og oppført i de svulstspesifikke handlingsprogrammene.
Andre momenter ved bildediagnostikk
Bildeveiledet kirurgi og strålebehandling
Bildeveiledning (nevronaviasjon) kan øke presisjonen ved svulstkirurgi. Før inngrepet utføres typisk 3D-opptak med MR (T2, FLAIR og T1 etter kontrast) som overføres til nevronavigasjonenheten på nevrokirurgenes operasjonsstue. Bildeveiledning med 3D MR-bilder benyttes også ved planlegging av strålebehandling av hjernesvulster.
Postoperativ bildediagnostikk
Etter kirurgisk reseksjon av hjernesvulst bør det utføres en kontrollundersøkelse med MR for å kartlegge grad av svulstreseksjon, samt vurdere eventuell forekomst av komplikasjoner som infarkter og hematomer. Denne undersøkelsen gir også grunnlag for planlegging av postoperativ stråleterapi og senere for kontroll av respons på eventuell radiokjemoterapi (baseline-bilder). Undersøkelsen skal utføres innen 48 timer etter kirurgi fordi man etter dette får reaktive, postoperative forandringer i hjernevevet som gjør vurderingen av bildene vanskelig (Wen et al., 2010). Bildeprotokollen bør inneholde samme sekvenser som primærutredningen.
Bildediagnostiske kontrollintervaller for hjernesvulstpasienter
Intervallene mellom hver MR-kontroll vil variere avhengig av klinikk og svulsttype. Mange hjernesvulster vokser langsomt og for å kunne oppdage tumorvekst kan det være nødvendig å studere svulstområdet med flere påfølgende MR-undersøkelser. Det er derfor ønskelig at pasientene kontrolleres på samme institusjon og med samme bildeprotokoll hver gang. På denne måten sikrer man at alle bildeundersøkelser og sammenlignbare bildesekvenser er tilgjengelig for radiologen som gransker bildene. Det er også viktig at kliniker i henvisningen til MR opplyser om eventuell steroidbruk, samt siste tidspunkt for tumorrettet intervensjon og hva denne intervensjonen var. I forskningssammenheng vil behandlingsrespons og endringer i størrelsen av høygradige hjernesvulster bli vurdert etter MacDonald-kriteriene eller Response Assessment in Neuro-Oncology (RANO)-kriteriene (Quant et al., 2011; Wen et al., 2010). MacDonald-kriteriene multipliserer maksimal diameter av kontrastoppladende svulster i to perpendikulære retninger på samme transversalsnitt. Hvis det er flere lesjoner summeres verdiene av disse produktene. Komplett respons defineres som fravær av kontrastoppladende tumorvev, mens partiell respons er > 50 % reduksjon i svulstdiameterprodukt. MacDonald-kriteriene har flere begrensninger, blant annet er de gyldig bare for kontrastoppladende svulster. Ved behandling med radiokjemoterapi er det ikke uvanlig at kontrastopptak oppstår som en behandlingseffekt (såkalt pseudoprogresjon) uten at det er reell neoplastisk progresjon, mens noen typer kjemoterapi kan føre til at kontrastopptak forsvinner uten at det er endring i svulstens volum (såkalt pseudorespons) (Caroline et al., 2012; Huang et al., 2015; Tran et al., 2013). Ved bruk av MacDonald-kriteriene vil slike forhold gi misvisende resultater. Derfor har man tatt i bruk og i flere runder videreutviklet et noe mer presist vurderingssystem, RANO-kriteriene. Disse er ikke veldig ulike MacDonald-kriteriene; hovedforskjellen er at man tar med ikke-kontrastladende forandringer i vurderingen av neoplastisk status. Dette systemet bøter på noen av svakhetene ved MacDonald-kriteriene, men kan ikke til fulle eliminere de biologiske usikkerhetene man har rundt vurdering av pseudoprogresjon versus reell neoplastisk progresjon. For vurdering av klinisk status, som inngår i både MacDonald- og RANO-kriteriene, har man utviklet et verktøy kalt Neurologic assessment in neuro-oncology eller NANO-skalaen, samt at eventuell glukokortikoidbruk inngår som del av grunnlaget for konklusjon om sykdomsstatus (Nayak et al., 2017).