ICD-10-klassifiseringen gjør ikke et tydelig skille mellom de to hovedtypene av premaligne tilstander i cervix, som er forstadier til plateepitelcarcinom og adenocarcinom. Disse tilstandene oppstår i henholdsvis plateepitel og sylinderepitel i cervix. Cervical intraepitelial neoplasi (CIN) er et begrep som brukes for å beskrive plateepiteldysplasi. CIN1 regnes som lavgradig dysplasi, mens CIN2 og CIN3, samt Adenocarcinoma in situ (AIS eller ACIS), klassifiseres som høygradig dysplasi. Begrepet CIN2+ inkluderer både høygradig dysplasi og karsinom. Tiden fra AIS oppdages til utvikling av adenokarsinom kan være kortere. For pasienter med både CIN og AIS, er det anbefalt å følge retningslinjene for AIS, som diskuteres nærmere i avsnittet 'Adenocarcinoma in situ' under kapittelet om diagnostikk.
N87.0 | CIN1 – Lett dysplasi |
|---|---|
N87.1 | CIN2 – Moderat dysplasi |
D06 | CIN3 – Grov dysplasi eller carcinoma in situ |
D06.0 | CIN3 eller AIS i endocervix |
D06.1 | CIN3 eller AIS på ektocervix |
D06.9 | CIN3 eller AIS på uspesifisert del av cervix |
(Normal) | Normal morfologi |
|---|---|
ASC-US* | Irregulære plateepitelceller med forandringer av usikker betydning (”Atypical squamous cells of undetermined significance”) |
ASC-H* | Irregulære plateepitelceller med forandringer som kan gi mistanke om høygradig lesjon, men som ikke oppfyller kriteriene til diagnosen HSIL (“Atypical squamous cells, cannot exclude high-grade squamous intraepithelial lesion”) |
AGUS* | Irregulært sylinder/kjertelepitel av usikker opprinnelse og/eller signifkans (“Atypical glandular cells of undetermined significance”) |
LSIL* | Lavgradig skvamøs intraepitel lesjon (“Low-grade squamous intraepithelial lesions”) |
HSIL* | Høygradig skvamøs intraepitel lesjon (“High-grade squamous intraepithelial lesions”) |
AIS/ACIS* | Adenokarsinoma in situ. |
Cancer | Alle typer cancer |
* Se ordforklaring i kapittelet om forkortelser/ordforklaringer.
Kilde: Kvalitetsmanual for Livmorhalsprogrammet, kap. 8 (Folkehelseinstituttet, 2025a); se også The Bethesda System 2014 (Nayar et al., 2015).
Forekomst
Kreftregisteret publiserer årsrapporter med oversikt over blant annet antall livmorhalsprøver, dekningsgrad, oppfølging og behandling for celleforandringer.
Årsrapport Livmorhalsprogrammet (fhi.no)
Etiologi og risikofaktorer
- Livstidsrisiko for cervical HPV-infeksjon hos uvaksinerte, seksuelt aktive kvinner er opp til 80 % (Stanley, 2010).
- Prevalensen av HPV-infeksjon varierer med alder (Castle et al., 2005) og er høyest blant unge kvinner. En studie rapporterer at omtrent 50% av ikke-vaksinerte norske kvinner i alderen 18–26 år tester positivt for HPV (Dillner et al., 2018).
- De fleste genitale HPV infeksjoner er asymptomatiske og er ikke lenger påvisbare innen 2 år (90 %) (Doorbar, 2023; Gravitt et al., 2017; Plotzker et al., 2023).
- Human papillomavirus (HPV) er påvist i over 99 % av tilfellene av cervixcancer og er en nødvendig faktor for utvikling av sykdommen, spesielt CIN 2+ og AIS (Bosch et al., 2013; IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, 2012; Muñoz et al., 2003; Walboomers et al., 1999)
- Onkogene HPV-typer bidrar til risikoen, og persisterende infeksjoner samt ekspresjon av onkoproteiner er kritiske for sykdomsprogresjonen. Dette risikobildet forverres av langvarige infeksjoner og tilstedeværelsen av flere onkogene genotyper (Schiffman et al., 2010
- Samtidig infeksjon med flere onkogene HPV-genotyper øker risikoen for CIN2+ (Schiffman et al., 2010).
- Ulike HPV genotyper har ulikt potensial for utvikling av cervixcancer. Fordelingen av HPV genotyper i en uvaksinert (barnevaksinasjonsprogrammet) screeningpopulasjon (Figur 1) er annerledes enn i cervixcancer (Figur 2):
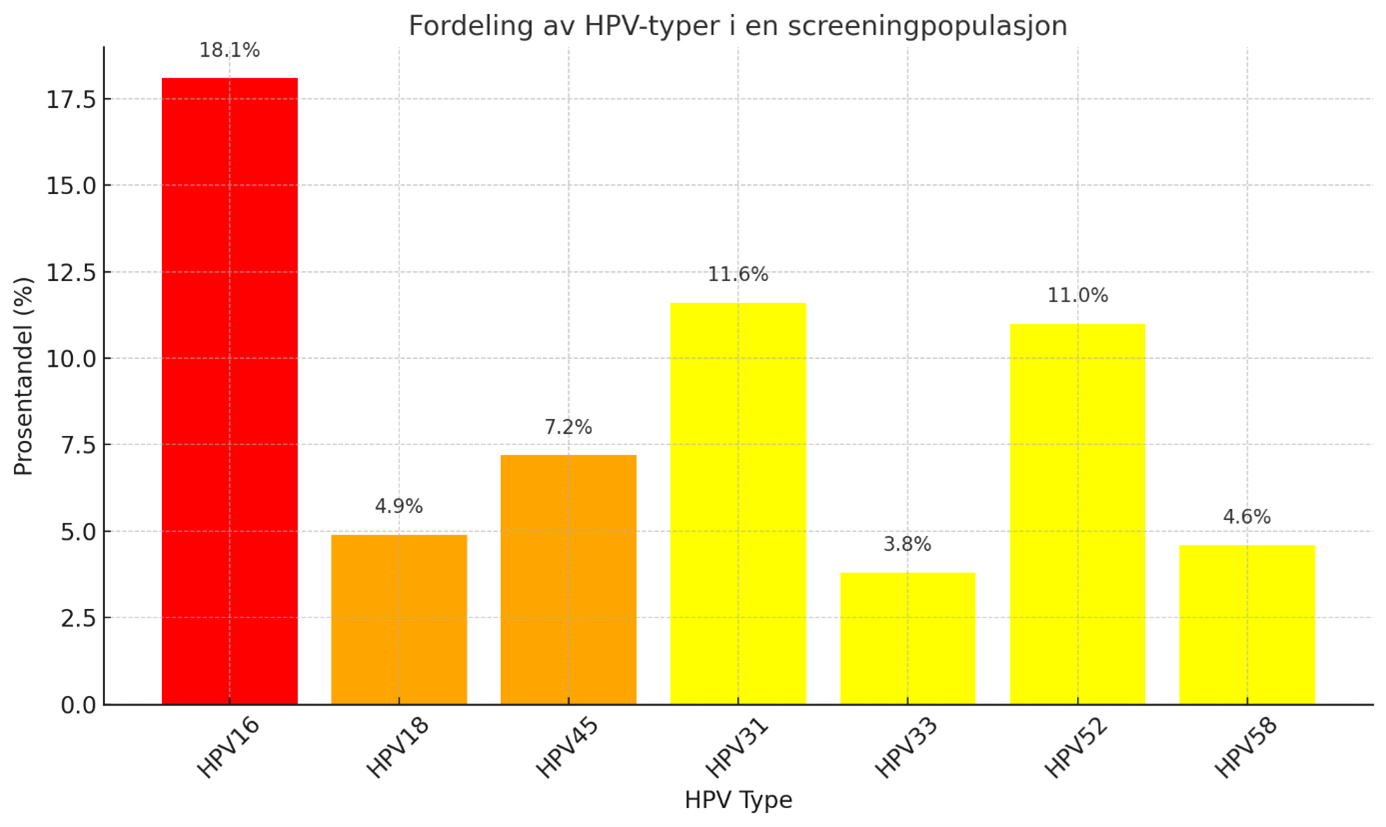
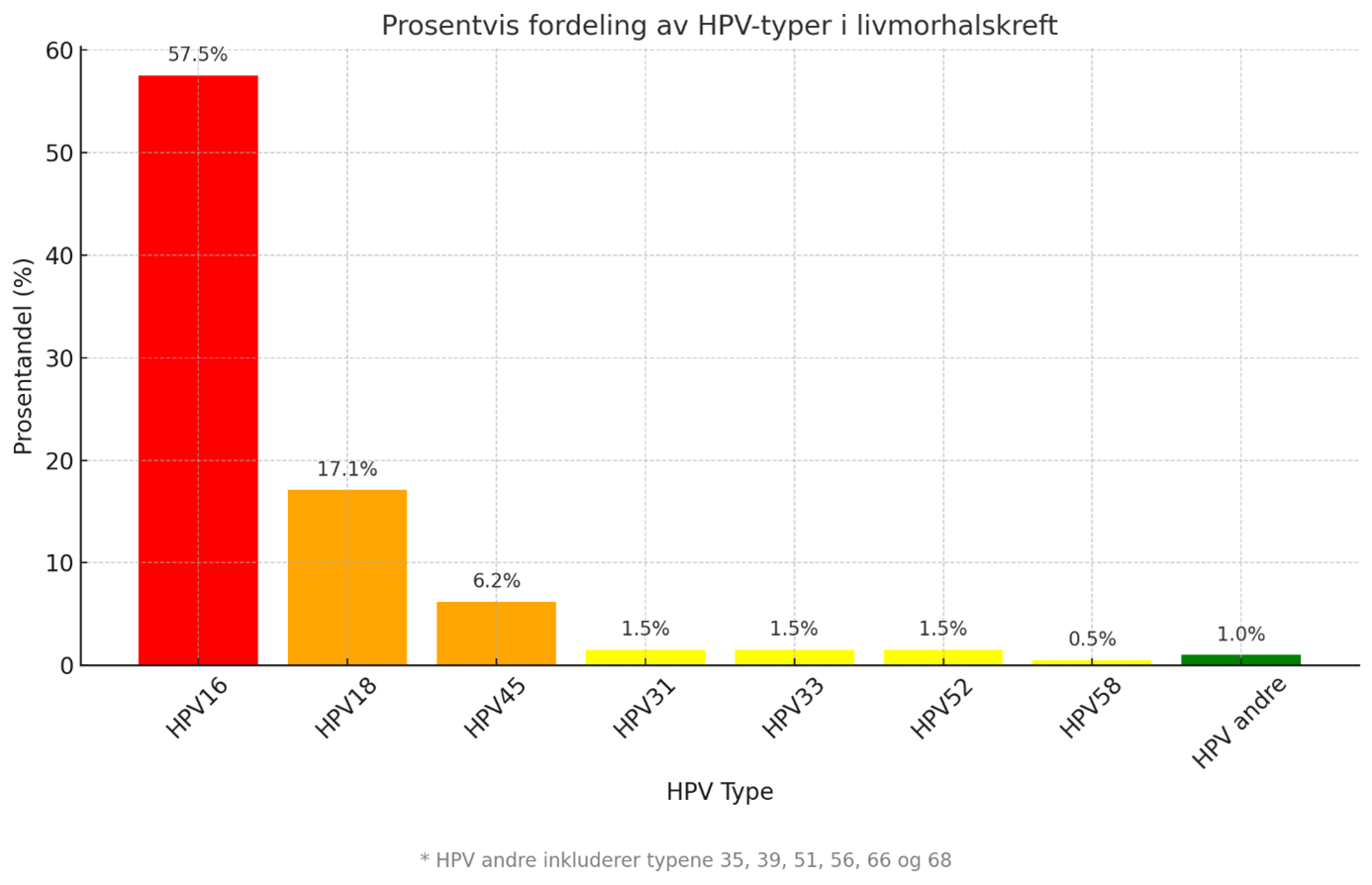
Basert på IARC Handbook of Cervical Cancer Prevention (Combes et al., 2014; IARC, 2022) og HPV tester godkjent til screening i Norge, har Kreftregisteret delt inn i følgende grupper i livmorhalsscreeningprogrammet:
- Høyprioritert (HPV 16)
- Middelsprioritert (HPV 18,31,33,45,52 og 58)
- Ikke-hastende (HPV 35,39,51,56,59,66,68)
Differensialdiagnoser
- Metaplasi (er en normal fysiologisk prosess og trenger ingen utredning)
- Kondylomer
- Cervixkarsinom
- Endometrieatypi
- Genitale infeksjonssykdommer
- Metastaser, lymfom, maligne mesenchymale svulster eller nevroendokrin cancer i cervix
Risikofaktorer for utvikling av CIN2+
- Immunsupprimerte (se eget avsnitt) (Bowden et al 2023, Moscicki AB et al 2019,
- Røyking (Bowden et al 2023, Gadducci et al., 2011; Kjellberg et al., 2000; Vaccarella et al., 2008).
- Tidlig seksuell debutalder og antall partnere (Bowden et al 2023, Dillner et al., 1996).
- Samtidig infeksjon med Chlamydia trachomatis og andre seksuelt overførbare infeksjoner (Bowden et al 2023, Silins et al., 2005).
- Arvelige faktorer som HLA-variasjon kan ha betydning for utvikling av CIN2+ (de Araujo Souza et al., 2009; Leo et al., 2017).
- Annen HPV-relatert precancer eller cancer (Forman et al., 2012).
Forløp/prognose
- Det er få studier som omfatter naturlig forløp av CIN. En studie har vist at 31 % av CIN3 som ikke ble behandlet progredierte til cancer i løpet av 30 år (McCredie et al., 2008). En betydelig andel CIN går i spontan regress (Castle et al., 2009; Tainio et al., 2018). Det finnes per i dag ingen etablert metode for å skille mellom dysplasier som går i regress og dysplasier som vil kunne progrediere til karsinom.
- Behov for rebehandling etter konisering er oppgitt å være ca 10 % første 2 år, uavhengig av frie reseksjonsrender (Ghaem-Maghami et al., 2009; Kocken et al., 2011; Paraskevaidis et al., 1991).
- Persisterende HPV-infeksjon av samme genotype etter konisering øker risikoen for residiv (Bogani et al., 2020; Iacobone et al., 2021), med størst risiko for residiv første 10 år etter behandling (Kocken et al., 2011). Negativ HPV test etter eksisjon av premaligne forandringer er assosiert med meget lav risiko for ny CIN2+ (Arbyn et al., 2017).
- De fleste tilfeller av adenocarcinoma in situ (AIS) er forbundet med HPV type 16, 18 og 45. I en europeisk studie var tiden fra AIS til utvikling av adenokarsinom for HPV 16 og 18 henholdsvis 13 og 6 år (Tjalma et al., 2013). For ytterligere detaljer, se seksjonen 'Adenocarcinoma in situ' i kapitlet 'Diagnostikk'.