I dag praktiseres rekkefølgen av klinisk undersøkelse, CT og cystoskopi forskjellig. Det har vært vanlig med klinisk undersøkelse og cystoskopi som første undersøkelser, og deretter CT for avklaring av de øvre urinveiene.
Dersom CT utføres før cystoskopi, vil man spare minimum èn konsultasjon fordi man unngår enda en kontakt for å informere om CT-svaret. Risikoen for falske negative cystoskopier og falske positive CT vil også trolig reduseres ved å utføre CT før cystoskopi, og man kan i noen tilfeller henvise direkte til TURB uten cystoskopi. For å redusere antall konsultasjoner og utredningstid, anbefales derfor CT abdomen som første undersøkelse.
Klinisk undersøkelse
Klinisk undersøkelse av bekkenet, inkludert rektal eksplorasjon og bimanuell palpasjon, anbefales generelt når man undersøker for hematuri. Imidlertid presenterer majoriteten av blærekreftpasientene seg med ikke-muskelinfiltrerende sykdom. Positive funn ved klinisk undersøkelse er sjeldne, og bare fremskredne tilfeller av blærekreft vil kunne påvises på denne måten. Klinisk undersøkelse gir derfor sjeldent funn i diagnostikk ved hematuri, men kan påvise annen sykdom hos pasienten.
Cystoskopi
Den kliniske diagnosen blærekreft vil normalt bygge på cystoskopi, som er en obligatorisk undersøkelse ved mistanke om blæresvulst. Hvis billeddiagnostikk, ev. kombinert med positiv cytologi i urin, gir sterk mistanke om blæresvulst, vil man likevel kunne gå rett på initialbehandling (TURB) uten å forutgående cystoskopi.
Hos menn gir undersøkelse med fleksibelt cystoskop mindre ubehag og en bedre pasientopplevelse enn undersøkelse med stivt instrument og er derfor å foretrekke (Krajewski et al., 2017).
Cystoskopi-undersøkelsen skal som et minimum gi følgende beskrivelse av svulst-tilstanden: størrelse, lokalisering, antall, utseende (papillomatøs/solid, stilket/bredbaset), urinjet fra ostier og utseende av slimhinnen utenom svulsten.
Svulst og annen slimhinnepatologi kan med fordel avmerkes på en standardtegning (figur 2). Status ved rektaleksplorasjon skal anføres.
For bruk av fluorescens-cystoskopi (PDD) og narrow band imaging (NBI), se under primærbehandling (kap. Visualiseringsteknikker ved endoskopi av blære).
Bilde kommer.
Anbefalinger
- Cystoskopi skal ved blæresvulst beskrive følgende forhold ved tumor og blære: størrelse, lokalisasjon, utseende, antall, urinjet fra ostier og ev. slimhinneforandringer utenom selve svulsten.
Billeddiagnostikk
Billeddiagnostikk ved primærutredning
CT abdomen
Ved makroskopisk hematuri anbefales kontrastforsterket CT abdomen. Hensikten er primært å utelukke UTUC, og studier har vist NPV >99 % uavhengig av hvilken CT-protokoll man velger (Cowan et al., 2007; Metser et al., 2012; Park et al., 2016). CT er også godt egnet for vurdering av blærecancer, men fortsatt regner man cystoskopi som den beste metoden (Blick et al., 2012; Helenius et al., 2015; Helenius et al., 2016). Tidligere har man som regel brukt tre- eller fire-fase CT, og den ekskretoriske fasen er ofte fremhevet som den mest sentrale for vurdering av urotelial cancer (Renard-Penna et al., 2020). Evidensen for at den ekskretoriske fasen forbedrer diagnostikken er mangelfull, og flere studier har vist at èn-fase CT er tilstrekkelig, og da foretrekkes sen urotelial/nefrografisk fase (Kim et al., 2014; Kupershmidt et al., 2011; Metser et al., 2012; Park et al., 2016; Takeuchi et al., 2015). Dette vil redusere stråledosen betraktelig, og korte ned undersøkelses- og granskningstiden slik at CT-kapasiten bedres. Behovet for supplerende kontrastfaser må individuelt vurderes ved usikre funn.
Risiko for ved bruk av kontrast ved CT
Det er ingen absolutt nedre GFR-grense for kontrastundersøkelse av urinveier, men forsiktighet bør utvises ved redusert nyrefunksjon. Europeiske retningslinjer er utarbeidet og revidert i 2018 av ESUR (European Society of Urogenital Radiology) (van der Molen et al., 2018a, 2018b) (esur.org). Hovedregelen er at man kan gi intravenøs jodholdig kontrast til pasienter som normalt ved e-GFR 30 eller høyere. Ved e-GFR under 30 ml/min, skal pasienten normalt hydreres opp på forhånd. Dette skal skje med intravenøs infusjon av ringer eller bikarbonat, og skal starte noen timer før undersøkelsen, eventuelt også pågå i etterkant. Det må vurderes redusert kontrast eller alternative metoder på individuell basis.
Dersom pasienten bruker metformin eller analoge medikamenter, skal disse seponeres etter anbefalte retningslinjer før intravenøs jodholdig kontrast, dersom e-GFR er 30 eller lavere. Metforminbruk må ikke gjenopptas før e-GFR er målt etter 48 timer og nivå vurdert som akseptabel av ansvarlig lege.
Om indikasjonen for CT er sterk nok, og adekvate alternativer ikke finnes, kan man gi kontrast etter forbehandling med væske, helst i samråd med nefrolog.
For detaljer se esur.org.
MR
MR er vanligvis ikke indisert som primær billeddiagnostisk utredning av makrohematuri.
Ultralyd
UL er vanligvis ikke indisert ved utredning av makrohematuri.
Billeddiagnostikk ved staging av blærecancer
CT abdomen og thorax
Kontrastforsterket CT abdomen i sen urotelial/ nefrografisk fase er førstevalg for staging av blærecancer.
CT kan ikke skille mellom NMIBC (<T2) og MIBC (T2), men kan påvise ekstravesikal tumorvekst (≥T3). CT er lite sensitivt (40-50 %) for deteksjon av lymfeknutemetastaser, og kirurgisk glandeltoalett regnes derfor som gullstandard. Hovedhensikten med CT-staging er derfor påvisning av ekstravesikal tumorvekst, og fjernmetastaser.
Dersom CT er utført før TURB i forbindelse med utredning av makroskopisk hematuri, vil denne være tilstrekkelig for abdominal staging. Det er viktig at CT utføres før TURB fordi TURB gir reaktive forandringer som feilaktig gir inntrykk av mer avansert sykdom.
Behovet for CT thorax vurderes individuelt før TURB, f.eks ved stor tumorvekst eller lokalavansert/metastatisk sykdom. Etter TURB, kan man supplere med CT thorax ved påvist MIBC og ved høy-gradig NMIBC.
MR blære
MR er bedre enn CT for å skille NMIBC og MIBC, men få sykehus har innført MR som rutine ved staging (Del Giudice et al., 2020). Noen studier ser nå på nytten av MR som erstatning til TURB før cystektomi, men konklusive resultater foreligger ikke (Bryan et al., 2021). Potensialet til MR er å selektere pasienter direkte til cystektomi uten TURB. Selv om man må avvente resultater fra kliniske studier, ansees det likevel som ønskelig at flere begynner med MR blære for lokal staging. Det vil da være viktig med lokal forankring og kvalitetssikring for å optimalisere kvaliteten. Det er viktig at også MR blære utføres før TURB og rapporteres i henhold til VI- RADS (Panebianco et al., 2018). Foreløpig er multiparametrisk MR (med kontrast) vanligst for staging, men flere studier raporterer likeverdige resultater ved bruk av bi-parametrisk MR (uten kontrast) (Ye et al., 2022).
MR har bedre sensitivitet enn CT for deteksjon av lymfeknutemetastaser. Lymfeknutetoalett er likvel gullstandard for N-staging, og har i tillegg terapeutisk gevinst ift øket overlevelse (Woo et al., 2018).
FDG-PET CT
Undersøkelsen anbefales foreløpig ikke i Norge ved utredning av blærecancer. FDG PET-CT er marginalt mer sensitivt enn vanlig CT for påvisning av lymfeknutemetastaser, men negativ undersøkelse erstatter ikke glandeltoalett ved cystektomi (Girard et al., 2019). Gevinsten av FDG PET-CT for deteksjon av fjernmetastaser i forhold til vanlig CT er usikker.
Anbefalinger
- Kontrastforsterket CT abdomen anbefales før cystoskopi. Èn-fase CT er som regel tilstrekkelig.
- CT abdomen tatt i forbindelse med primærutredning er tilstrekkelig for abdominal staging.
- Ved abdominal staging, er det viktig at CT gjøres før TURB.
- CT thorax anbefales ved påvist MIBC og ved høy-gradig NMIBC.
- Forsiktighet i forhold til kontrast bør utvises ved GFR < 30 ml/min.
- Det anbefales MR blære for staging under forutsetning av lokal forankring og kvalitetssikring.
Urinundersøkelser
Bakteriologisk undersøkelse
Denne undersøkelsen er nødvendig bare hvis klinikken gir mistanke om assosiert infeksjon.
Urincytologi
Cytologisk undersøkelse av eksfolierte cancerceller i urin kan være nyttig i følgende tilfeller:
- Tilbakevendende makroskopisk hematuri uten positive funn ved cystoskopi og bildeundersøkelse av øvre urinveier
- Usikkert cystoskopifunn
- Negativ cystoskopi hos pasient med suspekte urinveissymptomer (CIS)
- Negativ cystoskopi og mulig svulst i øvre urinveier ved bildeundersøkelse
- Oppfølging av enkelte pasienter (for eksempel CIS – se kap. Oppfølging)
Undersøkelsen kan gjøres i spontanurin eller i væske fra blæreskylling. Prøvetype skal alltid angis på remissen da dette kan ha betydning for tolkningen av eventuelle funn. Det anbefales at spontanurinen ikke skal være den første morgenurinen. Urinprøven skal tas en tid på døgnet da pasienten er godt hydrert for å sikre flest mulig bevarte celler i urinen og slik unngå cytolyse. En prøve tatt under pågående makroskopisk hematuri kan være vanskelig å tolke.
Urincytologi er mest pålitelig for påvisning av svulster av høy malignitetsgrad og CIS (sensitivitet 28–100 %). Svulster med lav malignitetsgrad gir positiv urincytologi i langt færre tilfeller (ca. 16 16 %) (Yafi et al., 2015). Tolkning av det cytologiske preparat kan være problematisk av flere grunner: Lavt celletall, degenerative/irritative forandringer (for eksempel stein) og terapiinduserte forandringer (BCG, stråleterapi). Det er derfor viktig at man anvender et laboratorium med erfaring i cytologisk vurdering og gir adekvate kliniske opplysninger til patologen (Raitanen et al., 2002) (evidensgrad C).
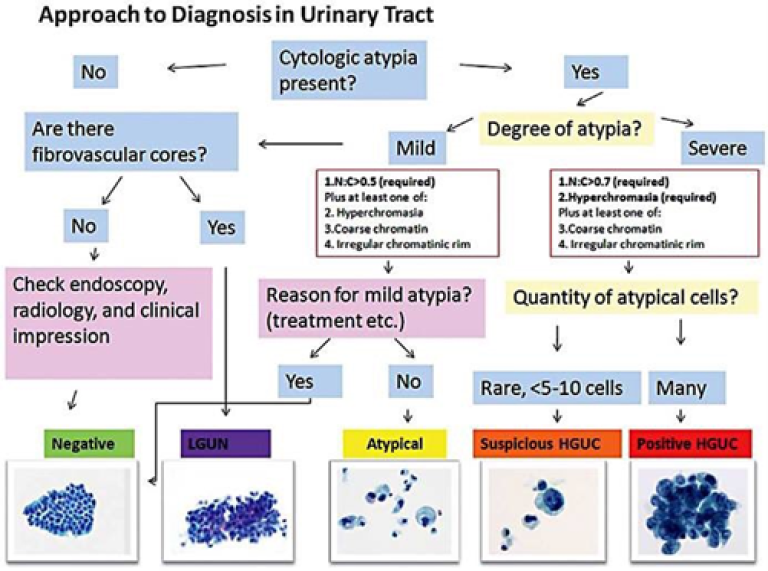
For å møte behovet for standardisering av terminologi og tolkning av funn er Paris-systemet for rapportering av urincytologi utviklet (Rosenthal et al., 2016), og dette anbefales brukt både av EAU (Babjuk et al., 2019) og av Norsk Forening for Klinisk Cytologi (NFKC). Systemet beskriver neoplastiske og enkelte ikke-neoplastiske tilstander i urin og gir forslag til terminologi (tabell 3) (figur 3).
Systemet deler inn svarrapportene i seks diagnosekategorier som kort beskrevet nedenfor.
1. Negativt for høygradig urotelialt carcinom (negativ)
Denne kategorien inkluderer alle entiteter som ikke medfører økt risiko for utvikling av høygradig urotelialt carcinom.
Kategorien inkluderer benigne og reaktive forandringer i urotel, kjertelepitel og plateepitel; benigne uroteliale vevsfragmenter og uroteliale flak og grupper; steinrelaterte forandringer; virusrelaterte forandringer og forandringer som kan tilskrives gjennomgått behandling inkludert epitelceller fra blæresubstitutt.
2. Atypiske urotelceller (AUC)
Kategorien omfatter prøver med urotelceller med lett til moderat cytologisk atypi. Vevsfragmenter og cellegrupper uten cytologisk atypi og tilfeller hvor det er kjent årsak til atypien (f.eks. virusrelaterte forandringer) kommer inn under normal-kategorien.
AUC inkluderer også prøver med uttalt degenerasjon/ dårlig bevarte prøver slik at atypiens natur ikke kan vurderes. Det bemerkes at kun degenerasjon ikke automatisk medfører AUC-diagnose.
3. Suspekt for høygradig urotelialt carcinom (suspekt)
Her inkluderes prøver med urotelceller med grov atypi som ikke helt møter kriteriene for høygradig urotelialt carcinom.
4. Høygradig urotelialt carcinom (HGUC)
Kategorien omfatter urotelceller med høygradig atypi, både høygradig urotelialt carcinom og CIS. Cytologisk kan man ikke skille mellom disse, men det er rapportert at bakgrunnen i CIS er renere.
5. Lavgradig urotelial neoplasi (LGUN)
Denne kategorien inkluderer både papillomer, PUNLMP og lavgradige uroteliale carcinomer. Å skille lavgradige lesjoner fra normalt urotel kan være meget vanskelig, og diagnosen bør kun stilles når man har sikre holdepunkter for at det foreligger lavgradig neoplasi.
Negativ cytologi utelukker ikke denne kategorien.
6. Annen malign sykdom (primær eller metastatisk) og diverse lesjoner
For eksempel rene plateepitelcarcinomer, rene adenocarcinomer, nevroendokrine carcinomer og sarkomer kommer inn under denne kategorien.
| Nr. | Kategori | Risiko for malignitet | Anbefalt oppfølging |
|---|---|---|---|
| 1 | Ikke diagnostisk | <5–10 % | Gjenta cytologi, cystoskopi om 3 måneder dersom økt klinisk mistanke |
| 2 | Negativ for høygradig urotelialt carcinom | 0–10 % | Klinisk oppfølging etter behov |
| 3 | Atypiske uroteliale celler | 8–35 % | Klinisk oppfølging etter behov |
| 4 | Suspekt for høygradig urotelialt carcinom | 50–90 % | Cystoskopi, biopsi |
| 5 | Høygradig urotelialt carcinom | >90 % | Cystoskopi, biopsi, stadieinndeling |
| 6 | Lavgradig urotelialt carcinom | 10 % | Cystoskopi, biopsi nødvendig for vurdering av grad og stadium |
| 7 | Andre primære og sekundære maligne svulster | >90 % | Cystoskopi, biopsi, stadieinndeling. Det som passer oppgitt diagnose. |
Oversatt fra Barkan et al. (2016). Copyright 2016 Elsevier. Gjengitt med tillatelse 2025.
Molekylære urintester
For å kompensere for urincytologiens svakheter, er tester for blæresvulstmarkør i urin forsøkt utviklet (tabell 4). BTA/BTA Stat (blæretumorantigen), NMP 22 (spesifikt kjerneprotein), fibrin degradasjonsprodukter, Immunocyt og UroVision er kommersielt tilgjengelige. Disse og andre tester har, som cytologi, sine svakheter. De fleste av disse testene har bedre sensitivitet enn cytologi for oppdagelse av blærekreft, men spesifisiteten er lavere. Falsk positive prøver vil derfor lede til unødvendige undersøkelser, bl.a. blærebiopsier. Pr. i dag har ingen urintester vist tilstrekkelig pålitelighet til å kunne overta for cytologi i diagnostikk og oppfølging av blæresvulster (Glas et al., 2003; Lokeshwar et al., 2005; Lotan et al., 2003; van Rhijn et al., 2005) (evidensgrad B).
Tabell kommer.
Anbefalinger
- Urincytologi er indisert ved følgende tilfeller:
- Tilbakevendende makroskopisk hematuri uten positive funn ved cystoskopi og bildeundersøkelse av øvre urinveier.
- Usikkert cystoskopifunn.
- Negativ cystoskopi hos pasient med suspekte urinveissymptomer.
- Negativ cystoskopi og mulig svulst i øvre urinveier ved bildeundersøkelse.
- Det anbefales at Paris-systemet for rapportering av urincytologi brukes.
- Urincytologi skal gjentas hvis den viser atypiske uroteliale celler i første prøve.
- Molekylære tester kan ikke erstatte cytologi grunnet lavere spesifisitet.