Preoperativ forberedelse og utredning
Informasjon gis av opererende kirurg og skal omfatte sykdom, utbredelse, forestående operasjon og komplikasjonsrisiko. Skriftlig informasjon bør gis i tillegg. Det skal journalføres at informasjonen er gitt og at pasienten har gitt sitt informerte samtykke.
Før operasjonen bør det tas blodprøver med minimum TSH, fritt T4, s-kalsium og ev. 25-hydroxyvitamin D. S-kalsitonin bør måles preoperativt, særlig ved mistanke om medullært thyroideakarsinom og før operasjon grunnet suspekt cytologi med manglende typiske trekk for papillær thyroideakarsinom.
Om det er mulig bør pasienten undersøkes preoperativt med ultralyd av operatøren eller med operatør til stede. Der dette ikke er mulig og der radiolog eller nukleærmedisiner har utført ultralydundersøkelsen under utredning av pasienten, bør bildene demonstreres ved MDT eller ses på av operatør sammen med radiolog i forkant.
Ved mistanke om lokalinvasiv tumorvekst eller metastaser i mediastinum, må det gjøres utvidet bildediagnostikk, eventuelt med tillegg av endoskopi i trachea og øsofagus.
Alle pasienter som opereres for thyroideakarsinom bør undersøkes med laryngoskopi preoperativt for å avdekke en eventuell rekurrensparese, uavhengig av symptomer. Dette fordi bare 30-40 % vil ha symptomer, sannsynligvis pga. gradvis kompensasjon og tilvenning idet paresen utvikles (Randolph et al., 2006). Det anbefales bruk av intraoperativ nervemonitorering (IONM) under operasjonen. Pasienter med preoperativ rekurrensparese bør henvises til regionssykehus for behandling. Postoperativ laryngoskopi bør utføres i følgende situasjoner:
- Manglende signal (vagusamplitude ≤ 100µV) før lukning av såret
- < 50 % av utgangsamplituden etter intraoperativ signaltap før lukning av såret
- Hes stemme postoperativt selv om det var normale IONM signaler
- Der IONM ikke er anvendt
Røntgen cervikal columna, for å avsløre atlantoaxial subluksasjon hos pasienter med reumatoid artritt, kan gi grunnlag for spesielle hensyn ved leie på operasjonsbordet.
Antibiotikaprofylakse gis ikke rutinemessig. Den kan likevel vurderes ved større residiv-operasjoner, perforasjon til mucosa, lang operasjonstid (> 4- 5 timer).
Medikamentell forbehandling før operasjon
Pasienter med hypertyreose bør få thyrostatisk behandling før kirurgi. Preoperativ D-vitamin-mangel øker risikoen for postoperativ hypokalsemi (Rubin et al., 2020), og risikoen kan reduseres ved forbehandling med D-vitamin (Khan Bhettani et al., 2019). Ved uttalt D-vitamin-mangel (25-OH vitamin D <30 nmol/L) bør det gis preoperativt tilskudd med vitamin D, for eksempel kolekalsiferol 25 000 – 50 000 IU peroralt.
Reseksjonsomfang thyroidea
Følgende begreper skal brukes:
- Hemithyroidektomi: komplett fjerning av en thyroidealapp inkludert isthmus og lobus pyramidalis
- Nesten-total hemithyroidektomi: hemithyroidektomi hvor maks. 1 gram thyroideavev står igjen
- Total thyroidektomi: fjerning av begge thyroidealapper, isthmus og lobus pyramidalis.
- Isthmusreseksjon innebærer kun fjerning av isthmus.
Nesten-total hemithyroidektomi kan være indisert ved vanskelige disseksjonsforhold paratrachealt for å beskytte nervus rekurrens og/eller parathyroideakjertel. Hvis det ikke gjøres total thyroidektomi/hemithyroidektomi, skal kirurgen nøyaktig beskrive omfanget av reseksjonen av hver lapp (begrepene subtotal lobektomi og subtotal thyroidektomi er upresise og bør unngås).
Follikulære neoplasier med ukjent malignitetspotensial
Avklaring av svulster i denne kategorien krever en nøyaktig histologisk vurdering og dermed er diagnostisk hemithyroidektomi nødvendig. For patologiske kriterier henvises til kapittel 5.
NIFTP har en eksellent prognose. Det er ikke rapportert om kreftrelaterte dødsfall og med en estimert risiko for tilbakefall < 1%. Det foreligger ikke indikasjon for total thyroidektomi eller radiojodbehandling. Oppfølgning av NIFTP skjer på likt linje som lav-risiko PTC. Lignende er også rapportert for WDT-UMP og det anbefales her heller ikke noe mer omfattende behandling eller oppfølging (Filetti et al., 2019).
Generell ansees også FT-UMP som indolent sykdom, men det er rapportert tilbakefall i form av fjernmetastaser med behov for total thyroidektomi og radiojodbehandling. Anbefaling for behandling og oppfølging av disse pasientene er vanskelig, siden det finnes kun få publiserte studier som inkluderer få pasienter. I en japansk studie er det rapportert at 1% av pasientene med FT-UMP utviklet fjernmetastaser (Ito et al., 2022). I en svensk analyse av 51 pasienter med FT-UMP fant man at tilbakefall var assosiert med TERT-mutasjon. Påvist TERT-mutasjon i slike tumores kan indikere større risiko for tilbakefall og en mer omfattende behandling (total thyroidektomi + radiojod) kan vurderes. Studien anbefaler gjennomføring av TERT-mutasjonsanalyse for å selektere pasienter som kan ha større risiko for tilbakefall (Hysek et al., 2019).
Generell ansees pasienter med FT-UMP som ferdigbehandlet med hemithyroidektomi og kontrollopplegg kan ligne for lav-risiko DTC. Imidlertid anbefales mer forsiktighet hos pasienter hvor det ble påvist TERT-mutasjon og persisterende høy eller stigende thyroglobulin kan gi indikasjon for mer utredning. Alle pasienter med follikulære neoplasier med ukjent malignitetspotensial bør diskuteres på MDT.
Differensiert thyroideakarsinom – risikostratifisering og kirurgi
Pasienter med DTC deles inn i tre ulike grupper basert på risiko for residiv og/eller restsykdom, som skissert i tabell 6. Selv om det postoperative histologiresultatet vil bestemme mange av faktorene som avgjør pasientens plassering i risikogruppe, må omfanget av den kirurgiske behandlingen bestemmes ut fra hvilken risikogruppe pasienten sannsynligvis havner i ut fra tilgjengelige opplysninger. Ultralydundersøkelsen vil som regel samsvare godt med histologibeskrivelse når det gjelder TNM-status.
En utfordring er at man i økende grad vektlegger andre faktorer enn TNM-status når risikogruppe skal bestemmes postoperativt. Særlig må man veie inn histologisk vekstmønster og subtyping, for eksempel tall-cell variant av PTC, og detaljer omkring lymfeknutemetastaser. Molekylære markører (f.eks. BRAF og TERT) får stadig større rolle. Usikkerhet omkring frie marginer må vektlegges. Virkeligheten blir derfor mer kompleks enn tabell 5 - når alle opplysninger foreligger postoperativt. Diskusjon og risikovurdering i MDT er essensielt.
Vurdering av kompletterende total thyroidektomi etter hemithyroidektomi
Histologisk diagnose DTC etter en hemithyroidektomi kan foreligge som tilfeldig funn, etter diagnostisk operasjon, eller etter operasjon for antatt lavrisiko-cancer.
Når histologisk diagnose foreligger, skal alle pasienter operert for thyroideakarsinom diskuteres i tverrfaglig multidisiplinært møte. Der tas det stilling til om pasienten trenger adjuvant behandling med radioaktiv jod. Om det er tilfelle må pasienten opereres med kompletterende operasjon til total thyroidektomi. Behandling med radioaktiv jod krever at hele thyroidea er fjernet for å få effekt av behandlingen. Det vises til avsnitt 7.3. Adjuvant radiojodbehandling er hovedindikasjon for kompletterende kirurgi.
Der det er påvist arvelig eller familiær NMTC (kriterier se avsnitt 6) eller gjennomført tidligere strålebehandling mot halsen bør kompletterende kirurgi vurderes.
Papillært thyroideakarsinom
PTC forekommer i en rekke varianter med ulik prognose. I 2022 utga WHO revisjon av klassifikasjonen, og gikk bort fra begrepet papillært mikrokarsinom for svulster opp til 10 mm (Baloch et al., 2022). Dette indikerer at man nå legger mer vekt på histologisk og molekylær subtyping og mindre vekt på størrelse når risiko og prognose skal estimeres (Lamartina et al., 2018; Moon et al., 2017; Vuong et al., 2017). Allikevel står T-stadium fortsatt sentralt i amerikanske og europeiske retningslinjer (Filetti et al., 2019; Haugen et al., 2016) som det norske handlingsprogrammet baserer seg på.
1. Lavrisiko PTC
Pasienter der utredningen har vist lavrisiko PTC inntil 20 mm i diameter og uten kliniske lymfeknutemetastaser, skal som hovedregel tilbys kirurgisk behandling med hemithyroidektomi uten lymfadenektomi. ATA 2015 (Haugen et al., 2016) og BTA 2014 (Perros et al., 2014) åpner for hemithyroidektomi ved tumores opptil 4 cm uten andre risikofaktorer. De fleste studier har vist at graden av kirurgi ikke påvirker residivrisiko eller mortalitet for denne gruppen (Adam et al., 2014; Bilimoria et al., 2007; Dralle et al., 2023; Lin et al., 2023). Ved isthmuskarsinom kan en isthmusreseksjon anses som tilstrekkelig.
Hemithyroidektomi anbefales hvis alle følgende faktorer er oppfylt:
- Tumor med diameter ≤ 4cm
- Ikke tidligere bestråling av halsen som barn og ungdom
- Ikke gjennomvekst av thyroideakapselen
- Ikke lymfeknutemetastaser > 2 mm og færre enn 5 stk.
- Ikke holdepunkter for familiært karsinom
- Ikke multifokalitet
- Ikke aggressiv histologi
- Ikke angioinvasivitet
En bør være klar over at noen av disse kriteriene bestemmes på histologipreparat – altså postoperativt. Ved mistanke om noen av de nevnte risikofaktorene, bør en total thyroidektomi vurderes primært. Alternativt kan en hemithyroidektomi utføres, men pasientene bør informeres om at det kan bli nødvendig med en kompletterende thyroidektomi på et senere tidspunkt. Denne informasjonen bør uansett gis til alle som opereres med hemithyroidektomi, da histologisk risikoklassifisering gir endelig bestemmelse for om det er indikasjon for behandling med radioaktiv jod etter kompletterende kirurgi.
Robot-assistert kirurgi kan tilbys på lik linje med tradisjonell kirurgisk behandling for pasienter med lavrisiko PTC (Cho et al., 2019).
Alternative behandlingsformer for lavrisiko PTC:
Tilfeldig påviste lesjoner i thyroidea på inntil 10mm skal som hovedregel ikke biopseres (se avsnitt "Utredning av tilfeldige funn i thyroidea"). Har man allikevel påvist PTC i en intrathyroidal lesjon på inntil 10mm, viser studier fra Japan (Ito et al., 2018) at denne pasientgruppen trygt kan tilbys observasjon (aktiv overvåkning). Det er foreløpig for få studier fra Europa til å sidestille observasjon med kirurgi i Norge, men observasjon kan tilbys til pasienter som ønsker det, eller som har stor perioperativ risiko på grunn av komorbiditet eller alder. Observasjon skal innebære årlig kontroll hos spesialist med ultralyd og thyroglobulinmåling. Observasjon bør unngås ved ung alder, positiv familieanamnese for thyroideakarsinom, tidligere strålebehandling, kolloid knutestruma, påviste lymfeknutemetastaser, dorsal beliggenhet eller mistanke om ekstrathyroidal vekst. Pasientene bør har blitt diskutert på MDT.
For pasienter som er uegnet for kirurgi på grunn av komorbiditet eller ikke ønsker anbefalt kirurgi kan ultralydveiledet ablasjonsbehandling være et alternativ ved lavrisiko PTC inntil 10 mm (Mauri et al., 2021; Orloff et al., 2022). Det finnes flere teknologier som induserer varme i svulstene for å destruere vevet: laser-, mikrobølge- og radiofrekvens-ablasjon. Behandlingen må anses som eksperimentell, og det mangler internasjonal konsensus (Tuttle et al., 2023). Det er problematisk at man ødelegger muligheten til histologisk undersøkelse, og resultater fra langtidsoppfølgning mangler.
2. Ikke lavrisiko PTC
Pasienter som ut fra preoperativ utredning tilhører intermediær risikogruppe kan tilbys både hemithyroidektomi og total thyroidektomi. Pasientene bør informeres om at hemithyroidektomi vil kunne medføre behov for kompletterende total thyroidektomi, og at en total thyroidektomi vil kunne bety unødvendig stort omfang av kirurgien og derved større komplikasjonsrisiko, spesielt for hypoparathyroidisme. Samtale om fordeler og ulemper, avveininger er forutsetning før operasjonen.
For pasienter med antatt høy risiko skal total thyroidektomi anbefales. Dette gjelder hvis minst en av følgende faktorer er til stede:
- Tumor med diameter større enn 4 cm
- Forekomst av lymfeknutemetastaser > 2mm el flere enn 5 stk.
- Gjennomvekst av thyroideakapselen
- Tidligere bestrålt hals
- Familiært thyroideakarsinom
- Vaskulær invasjon
- Aggressiv histologi
- Multifokalitet
Diagnostiske operasjoner
I en rekke tilfeller kan ikke kreftdiagnosen slås fast preoperativt, og pasienten opereres i diagnostisk (og potensielt terapeutisk) øyemed. I disse situasjonene anbefales vanligvis hemithyroidektomi, samtidig som kirurgi i én seanse bør tilstrebes. BRAF analyse ved FNC preoperativt kan være av nytte (se avsnitt "Molekylære markører ved finnålscytologi"). Frysesnitt kan i utvalgte tilfeller være behjelpelig for intraoperativ beslutning (se avsnitt "Frysesnitt").
Follikulært thyroideakarsinom
Preoperativ utredning og spesielt cytologisk undersøkelse kan ikke skille mellom follikulære adenomer og karsinomer. Hvis samlet vurdering av all diagnostisk informasjon indikerer follikulær neoplasi, bør pasienten anbefales diagnostisk hemithyroidektomi. Ved tegn til gjennomvekst av thyroideakapselen eller andre bildediagnostiske tegn på malignitet bør total thyroidektomi overveies i same seanse, spesielt hos eldre.
Hvis endelig histologisk diagnose bekrefter at det foreligger follikulært adenom, er pasienten ferdigbehandlet.
Hvis endelig histologisk diagnose bekrefter at det foreligger FTC er videre behandling avhengig av utført primæroperasjon, histologisk diagnose og tumordiameter. FTC inndeles av WHO i tre hovedtyper (se avsnitt "Klassifisering" under "Mikroskopisk vurdering")
- Minimal-invasivt FTC (miFTC)
- Innkapslet (encapsulated) angioinvasivt FTC (eaFTC)
- Grov-invasivt (widely invasive) FTC (wiFTC)
miFTC tilhører lavrisikogruppe, mens wiFTC har høy risiko for residiv og metastasering. eaFTC har lav til intermediær risiko. Tidligere forslått antall av karinfiltrasjon for risikovurdering er omdiskutert, likevel kan graden av karinfiltrasjon (se avsnitt "Klassifisering" under "Mikroskopisk vurdering") være behjelpelig for videre risikostratifisering og dermed for anbefaling av total thyroidektomi og behandling med radioaktiv jod.. Pasientene bør diskuteres på MDT møte.
Indikasjonen for total thyroidektomi samsvarer med indikasjonen for radiojodbehandling:
- FTC med utbredt invasivitet eller karinvasjon
- Minimalt invasiv FTC med diameter > 4 cm
- Onkocytært karsinom
- Påvist metastaser
Hemithyroidektomi kan anses som tilstrekkelig hvis ingen av disse faktorene er til stede.
FTC metastaserer i liten grad til lymfeknuter og lymfadenektomi utføres ikke profylaktisk, kun ved påviste metastaser.
Lite differensiert og differensiert høygradig thyroideakarsinom
Ved lite differensiert thyroideakarsinom (PDTC) og differensiert høygradig thyroideakarsinom (DHGTC) bør det utføres total thyroidektomi og sentral lymfadenektomi. Hos høyrisiko-pasienter (f.eks. høy alder, rekurrensparese på tumorsiden) kan det ved unilateral tumor unntaksvis vurderes å utføre kun en hemithyroidektomi.
Lymfadenektomi ved differensiert thyroideakarsinom
- Profylaktisk sentral lymfadenektomi bør utføres ved:
- papillær thyroideakarsinom cT3+cT4
- påvist laterale lymfeknutemetastaser
- lite differensiert eller differensiert høygradig TC
- Thyroidektomi uten profylaktisk sentral lymfadenektomi er tilstrekkelig for små PTC (T1 eller T2).
- Det er ikke indikasjon for profylaktisk sentral lymfadenektomi ved FTC, kun ved påviste laterale lymfeknutemetastaser.
- Lymfadenektomi bør gjennomføres systematisk
Anatomi lymfeknuter cervikomediastinal
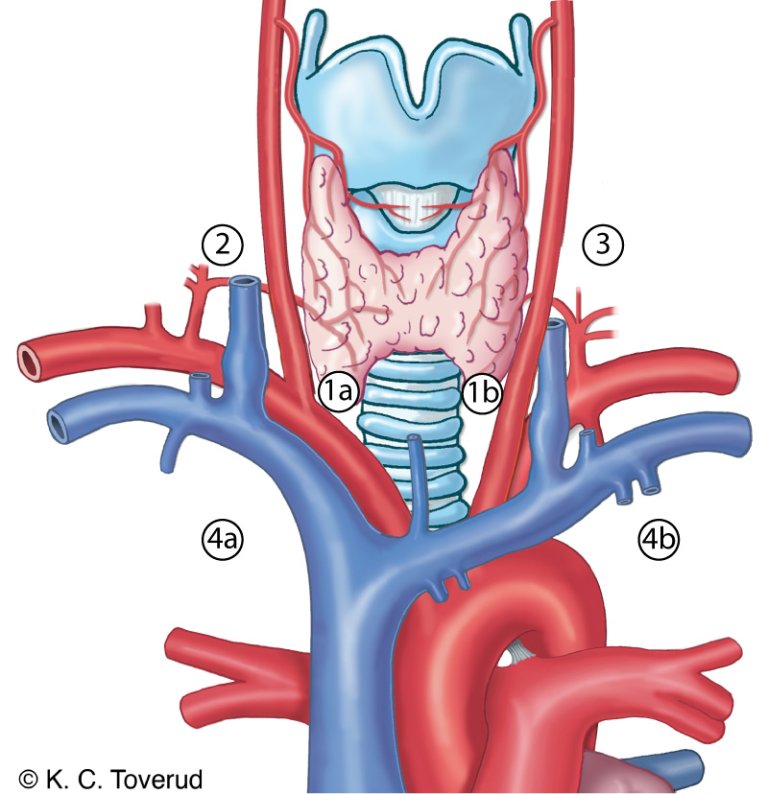
De regionale lymfeknutene omfatter det sentrale kompartment, de laterale cervikale og de øvre mediastinale lymfeknutene. Disse kan beskrives med Dralles kompartmentsystem (bilde 3) eller med UICC (Robbins) system (bilde 3+4, tabell 8).
- Kompartmentsystem (Dralle) med et sentralt, to laterale og et mediastinalt kompartment
- UICC system med seks nivå på hver side og et mediastinalt nivå
Bilde 3: Lymfeknutekompartment etter Dralle:
Bilde 4: UICC lymfeknutekompartment:
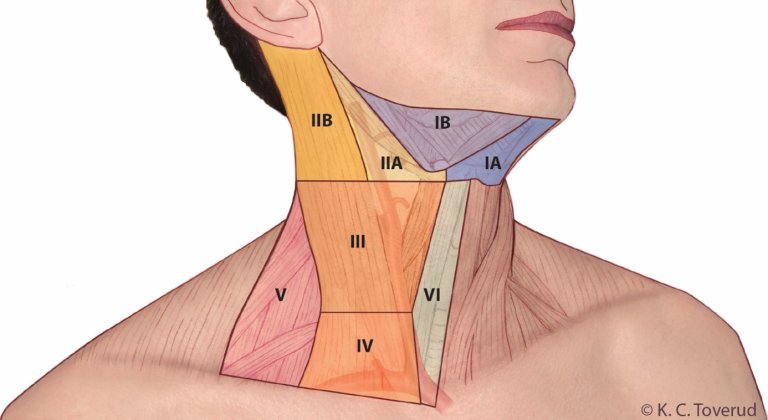
| Kompartmentsystem (Dralle) | UICC system (Robbins)1 |
|---|---|---|
Cervikosentrale lymfeknuter | Kompartment 1 1a høyre side 1b venstre side | Nivå I (submentale og submandibulære lymfeknuter) Nivå VI sentrale lymfeknuter Nivå VII inferiore sentrale lymfeknuter2 |
Cervikolaterale lymfeknuter | Kompartment 2 høyre side Kompartment 3 venstre side | Nivå IIA, IIB øvre jugulære lymfeknuter Nivå III midtre jugulære lymfeknuter Nivå IV nedre jugulære lymfeknuter Nivå VA, VB laterale jugulære lymfeknuter |
Mediastinale lymfeknuter | Kompartment 4 (øvre infrabrachiocephale lymfeknuter) 4a høyre side 4b venstre side | – |
1Nivå I (submentale og submandibulære lymfeknuter) er ikke del av det sentrale kompartmentet
2Nivå VII beregnes som inferior del av det sentrale kompartmentet, og som omfatter lymfeknutene som ligger superiort for vena brachiocephalica sinistra og som ofte ikke kan fjernes via cervikal tilgang
Egenprodusert.
Regionale (cervikale) lymfeknutemetastaser kan være til stede på diagnosetidspunktet i 20–90 % ved papillære karsinomer. Det er viktig at pasienter med påvist thyroideakarsinom får undersøkt hele halsen med ultralyd preoperativt (se avsnitt 5.3). Det skilles mellom profylaktisk og terapeutisk lymfadenektomi. Profylaktisk (ev. diagnostisk) lymfadenektomi beskriver fjerning av lymfeknuter som verken klinisk eller billedmessig viser tegn til metastaser. Ved terapeutisk lymfadenektomi er det påvist metastaser pre- eller perioperativt.
Som hovedregel utføres ikke profylaktisk lymfadenektomi ved lavrisiko-karsinom, selv om man forventer å finne mikroskopiske metastaser hos opp til 1/3 av pasientene. Dette fordi man ikke har holdepunkter for at profylaktisk lymfadenektomi har betydning for langtidsprognosen. Sentral lymfadenektomi er assosiert med postoperativ hypoparathyroidisme, men også for forbigående og permanent stemmebåndsnerveskade. Det som allikevel kan tale for profylaktisk lymfadenektomi er i de tilfellene man ønsker å behandle PTC 1-4 cm med hemithyroidektomi, og der metastaser i sentrale halsfelt vil avgjøre indikasjonen for radiojodbehandling og dermed kompletterende total thyroidektomi (diagnostisk).
Pasienter med T3 og T4 PTC har nesten alltid makroskopiske metastaser i sentrale halsfelt og bør få utført sentral lymfadenektomi ved primæroperasjonen fordi det bedrer lokal kontroll (Barczyński et al., 2013a). Ved preoperativ påviste lymfeknutemetastaser skal det utføres terapeutisk lymfadenektomi, både sentral og lateral.
Terapeutisk mediastinal lymfadenektomi skal vurderes ved mediastinale lymfeknutemetastaser. Operasjonsindikasjon bør diskuteres tverrfaglig på MDT med hensyn til tumorbiologi, alder og komorbiditet.
Utfører man lymfadenektomi er det viktig å utføre dette kompartmentorientert (systematisk) med fjerning av alle lymfeknutene og alt fettvev i et kompartment og ikke som fjerning av bare enkelte knuter («berry picking»). Reoperasjon i det sentrale og laterale halsfelt er assosiert med mindre radikalitet og høyere komplikasjonsrisiko.
Sentral lymfadenektomi (nivå VI)
Sentral lymfadenektomi (nivå VI) omfatter de prelaryngeale, pretracheale og paratracheale/-øsofageale lymfeknutene. Ved kirurgi i denne regionen er både nervus laryngeus rekurrens, nervus laryngeus superior (ramus externus) og parathyroideakjertler i fare for å bli skadet. Disseksjon må derfor utføres med spesiell forsiktighet. På høyre side er det også viktig å fjerne fett- og lymfvevet retronerval (bak nervus laryngeus rekurrens).
Nervus laryngeus rekurrens identifiseres alltid og følges visuelt. Bruk av intraoperativ nervemonitorering særlig ved bruk av permanent overvåkning av nervus vagus kan være en fordel og anbefales. Nervus laryngeus superior identifiseres, visuelt eller «negativt» ved at operatøren ser at nerven ikke inkluderes ved ligering av øvre polkar.
Parathyroideakjertlene identifiseres, de to øvre kan ofte dissekeres fri med nativ karforsyning, mens de to nedre ikke sjelden må autotransplanteres (vevsdiagnosen parathyroidea kan ved behov kontrolleres med frysesnittundersøkelse). Implantasjonsstedet merkes med ikke-resorberbar tråd for å lette senere identifisering.
Lateral lymfadenektomi (nivå II, III, IV og V)
Dersom det er påvist metastaser til lymfeknuter i det laterale halsfelt, skal det utføres systematisk lymfadenektomi, med bevaring av nervus accessorius, nervus vagus, nervus phrenicus, nervus hypoglossus, sympatiske grensestreng, plexusfasciklene, musculus sternocleidomastoideus og vena jugularis interna.
Omfang av lateral lymfadenektomi ved DTC er ikke tilstrekkelig validert. Det er ikke klart om det ved lymfeknutemetastaser lokalisert til kun et nivå vil være tilstrekkelig å fjerne kun dette nivå, eller om det bør gjøres fullstendig kompartmentdisseksjon. Siden det ikke er mulig å utelukke flere metastaser ved påvist metastase i et nivå, bør fullstendig kompartmentdisseksjon utføres for å redusere residivrisiko.
Mediastinal lymfadenektomi
Etter Robbins klassifikasjonen omfatter nivå VII kun lymfeknutene som ligger superiort for vena brachiocephalica sinistra (anonyma). Det mediastinale kompartment etter Dralle inkluderer også de infrabrachiocephale lymfeknutene som kan bli involvert hos inntil 5–10 % av pasientene med store tumores. Mediastinal lymfeknutedisseksjon krever derfor vanligvis sternumsplitt, særlig hvis de retrocavale paratracheale lymfeknutene skal fjernes.
Ved mediastinal lymfeknutedisseksjon bør nervus vagus, nervus rekurrens og nervus phrenicus identifiseres og bevares.
Det er ingen indikasjon for profylaktisk mediastinal lymfeknutedisseksjon.
Kirurgi ved lokoregionalt residiv
Ved lokalt residiv er det vanligvis indikasjon for ny operasjon. Omfang og tidspunkt for operasjonen bør bestemmes individuelt i forhold til estimert prognose, pasientens situasjon og operasjonsrisiko.
Det bør skilles mellom lokalt residiv som oftest er lokalisert paratrachealt eller paraøsofagealt, med økt risiko for infiltrasjon av vitale organer og nervus laryngeus rekurrens, og lymfeknutemetastaser. Det kan også forekomme bløtvevsmetastaser i for eksempel muskulaturen.
Noen residiv vokser veldig langsomt og kan til og med i noen tilfeller observeres, mens andre residiv viser rask progresjon som krever hurtig operasjon. Vurderingen krever god kunnskap og betydelig erfaring med slike pasienter. Kirurgien bør utføres ved sentra med tilstrekkelig erfaring og mulighet for nervemonitorering.
Som ved primærkirurgi bør kirurgi ved residiv utføres som systematisk og kompartment-orientert kirurgi. Ved residiv i et tidligere systematisk operert kompartment, kan selektiv lymfadenektomi være tilstrekkelig. Ved residiv i det sentrale kompartment anbefales lateral tilgang (mellom rette halsmuskulatur og musculus sternocleidomastoideus) for lettere kompartment orientert lymfadenektomi og tidlig visualisering av nervus laryngeus rekurrens.
Hos pasienter som ikke er operable, og ved nye lymfeknutemetastaser i allerede opererte områder, kan ultralydveiledet etanolinjeksjon diskuteres som et alternativ til kirurgi, men det foreligger lite data i litteraturen spesiell ingen prospektive studier som sammenligner kirurgi med ethanolablasjon. Det er viktig at pasienten informeres nøye om dette (Frich et al., 2022; Hay et al., 2022; Heilo et al., 2011).
Lokalavansert thyroideakarsinom
Dette er en undergruppe der utredning og behandling skiller seg fra anbefalte retningslinjer for behandling av thyroideakarsinom uten lokal invasivitet, og utredning og behandling må tilpasses dette. Lokalt invasiv thyroideakarsinom representerer en alvorlig prognostisk gruppe i en ellers relativt indolent pasientpopulasjon. Kirurgien må ivaretas og utføres i sentra med tilstrekkelig spesifikk ekspertise og i samarbeid med et tverrfaglig team som dekker alle behandlingsopsjoner. Differensieringsgrad og invasjonsmønster er av stor betydning for behandlingsstrategi. Forekomsten er ca. 15 % (3–16 %) av nydiagnostiserte pasienter med thyroideakarsinom.
Lokalavansert thyroideakarsinom defineres som T4 stadium med infiltrasjon i omliggende strukturer/organer. Ved lokalavansert karsinom finnes det innvekst i nervus laryngeus rekurrens (opptil 69%), trachea/larynx (42 %), øsofagus/farynx (21 %), vena jugularis interna og (veldig sjelden) arteria carotis communis (Hotomi et al., 2012; McCaffrey et al., 1994; Nishida et al., 1997; Wada et al., 2006). Vanligvis er det direkte ekstensjon fra tumor i thyroidea, men også lokal innvekst fra metastaser kan gi tilsvarende problemer.
Lokal invasivitet er en prognostisk negativ faktor og indikerer en redusert langtidsprognose. Sammenlignet med andre prognostiske faktorer som alder, kjønn, histologi, tumorstørrelse og fjernmetastaser, er ekstrathyroidal invasjon faktoren som har størst negativ betydning for pasienter med høy-differensiert thyroideakarsinom med reduksjon fra 91 % til 45 % ti-års overlevelse. Hos ca. 50 % av pasientene som dør av DTC skyldes det lokal tumorinvasjon, hovedsakelig på grunn av kvelning og blødning ved lokoregionalt residiv.
Reseksjoner av nervus laryngeus rekurrens, trachea, øsofagus og larynx medfører signifikant postoperativ morbiditet. Behovet for radikalitet må veies opp mot morbiditet som følge av kirurgi og ekstensive reseksjoner. Ved høyt differensierte krefttyper er lokal mikroskopisk radikalitet sannsynligvis ikke så avgjørende for langtidsprognosen som ved lavt differensierte varianter der særlig effekt av radioaktiv jod ikke kan påregnes.
Kirurgisk reseksjon er av avgjørende betydning i behandling av lokalavansert DTC, med komplett reseksjon med frie marginer som hovedmål. Denne gruppen skal også ha ablasjon med radioaktivt jod og TSH-suppresjonsbehandling. Hos enkelte bør ekstern strålebehandling vurderes særlig ved ikke mikro- eller makroskopisk frie reseksjonsrender.
Strategi for kirurgisk reseksjon ved invasiv vekst
1. Rette muskulatur
Ved mistanke om invasjon bør musculus sternothyroideus fjernes, evt. også musculus sternohyoideus. Enkelte anbefaler regelmessig reseksjon av musculus sternothyroideus ved anteriort beliggende tumor. Dette har lite eller ingen funksjonell følge, med mulig unntak for sangere. Ekstrathyroidal vekst som involverer kun de rette halsmusklene påvirker ikke sykdoms-spesifikk overlevelse som nylig publisert (Park et al., 2018; Song et al., 2019; Yoon et al., 2020).
2. Nervus laryngeus rekurrens
En preoperativt fungerende nerve som er adherent til et karsinom eller lymfeknutemetastase, kan ofte dissekeres fri fra tumor og bevares uten reseksjon, så lenge det ikke etterlates noen makroskopisk tumor. Studier har vist at det ikke er forskjell i overlevelse ved reseksjon kontra preservasjon, så lenge det gis radioaktiv jod. Jod-aviditet er imidlertid vanligvis ikke kjent preoperativt, men histologisk aggressiv eller lavt differensiert tumor er mulig indikasjon for mer aggressiv kirurgi. Når nerven er infiltrert og har nedsatt funksjon bør den komplett resesseres en bloc med tumor. Kompensatorisk korrigerende kirurgi i form av thyroplastikk (dersom symptomatisk) kan vurderes senere. Nervesutur eller interposisjon av nerver (for eksempel ansa cervicalis) kan vurderes. Veldig sjelden kan lokal kompresjon av nerven medføre nedsatt funksjon. Nerven bør i så fall om mulig bevares siden funksjonen kan komme tilbake etter dekompresjon.
Bilateral rekurrensparese er en alvorlig komplikasjon som vanligvis fordrer trakeotomi for å holde fri luftvei. Preoperativ stemmebåndsundersøkelse er avgjørende for å unngå reseksjon av eneste fungerende nervus rekurrens, og det anbefales sterkt intraoperativ nervemonitorering særlig dersom det foreligger en preoperativ ensidig rekurrensparese.
3. Trachea
Invasjonsmønsteret og dybdeinfiltrasjon er av avgjørende betydning ved valg av kirurgisk strategi. Grad av infiltrasjonen deles i fire stadier.
Ved stadium 1 er tumorvev kun adherent mot perikondriet og kan ofte fjernes ved hjelp av tangential veggreseksjon (shaving).
Ved inn- eller gjennomvekst av veggen (stadium 2-4) bør kirurgi i form av tracheareseksjon utføres, enten som vindu med rekonstruksjon, eller circumferensiell med ende til ende anastomose. Frysesnitt for vurdering av marginer anbefales. Vanligvis kan 5–6 cm av trachea resesseres. Dette er prosedyrer som kun bør utføres ved sentra med betydelig spesifikk kirurgisk kompetanse og intensivmedisinsk ekspertise (Brauckhoff, 2014; Lorntzsen et al., 2020a).
4. Larynx
Invasjon i larynx er indikasjon for individuell tilrettelagt kirurgisk strategi og vanligvis partiell laryngeal reseksjon i samarbeid med ØNH.
5. Øsofagus
På grunn av anatomiske forhold involveres øsofagus vanligvis sent, og oftest kun muskularis-laget, veldig sjelden mucosa. Muskularislaget kan fjernes og behøver ingen rekonstruksjon. Plassering av en stor sonde i øsofagus er til hjelp i vurderingen av om det er mulig å spare mucosa. Dersom gjennomgående reseksjon er nødvendig, må denne lukkes eventuelt med vaskularisert lapp, og må utføres av kirurg med spesifikk rekonstruktiv erfaring. Autolog tynntarmtransplantasjon kan være nødvendig.
6. Karinvasjon
Det foreligger relativt sjelden innvekst i vena jugularis interna eller arteria carotis communis. Vena jugularis interna kan ukomplisert fjernes på en side. Ved bilateral vena jugularis interna infiltrasjon skal man vurdere rekonstruksjon med autolog graft for å unngå alvorlig venestuvning. Dersom indisert, krever reseksjon av arteria carotis communis vanligvis interponat med vene eller protese i samarbeid med karkirurg.
Profylaktisk kirurgi
Ved familiær DTC er det vanligvis ikke indikasjon for profylaktisk kirurgi (thyroidektomi).
Medullært thyroideakarsinom
- Medullært thyroideakarsinom er sjelden
- Kirurgisk behandling er eneste kurative behandling
- Nøyaktig og tilstrekkelig primærkirurgi er avgjørende for prognosen
- Mange lever med biokjemisk sykdom og gjentatte residiv hvor valg av videre behandling er vanskelig og krever erfaring og ekspertise
- Pasienter med insidentelt funn av MTC bør henvises til regionsykehus for videre vurdering og oppfølging
- 25% av MTC er av arvelig type med mutasjon i RET proto-oncogene
- Familier utredes og profylaktisk thyroidektomi tilbys genbærere.
- Operasjon hos MEN2 genbærere i alderen < 16 år bør sentraliseres til OUS og HUS
Medullært thyroideakarsinom (MTC) er en sjelden sykdom, og i en norsk epidemiologisk studie fra tiden 1994-2016 utgjorde MTC 4,2% av thyroideakarsinom i Norge (Opsahl et al., 2019b). MTC regnes som en mer avansert og alvorlig sykdom enn differensiert thyroideakarsinom, og har gjerne tidlig i sykdomsforløpet lymfeknute- og fjernmetastaser (skjelett, lunge, lever). På grunn av disse forhold, bør pasienter med MTC kun behandles ved regionsykehus.
Sporadisk og arvelig form
Medullært thyroideakarsinom opptrer vanligst som sporadisk MTC, men omlag 25 % av pasientene med MTC har en arvelig bakgrunn med autosomal dominant aktiverende kimbanemutasjoner i RET (REarranged during Transfection) proto-oncogene (Donis-Keller et al., 1993; Mulligan et al., 1993). Arvelig MTC er ledd i multippel endokrin neoplasi type 2A (MEN 2A) (90-95%) og MEN2B (5-10%), med mutasjons-avhengig risiko for feokromocytom hos både MEN2A og MEN2B, og primær hyperparathyroidisme kun hos MEN2A (genotype-fenotype-korrelasjon) (Eng et al., 1994; Kebebew et al., 2000; Pelizzo et al., 2007). Ved MEN 2B er det også karakteristisk fenotype og det vises til kapittel 6 (Brauckhoff et al., 2004).
MEN 2 deles inn i tre risikoklasser etter hvilket codon som er mutert: ATA risikoklasse moderat og høy som er MEN 2A, og ATA risikoklasse høyest som er MEN 2B. Dette er definert av American Thyroid Association (ATA) og ble revidert i ATAs retningslinjer 2015 (Wells et al., 2015). Gjeldende anbefalinger for oppfølging og behandling i henhold til ATAs nyeste retningslinjer er angitt i tabell 9.
| ATA risikoklasse (2015) | Mutert Codon1 | Anbefalt tidspunkt for thyroideakirurgi og oppfølging Barn | Anbefalt tidspunkt for thyroideakirurgi og oppfølging Voksen | |
|---|---|---|---|---|
MOD (moderat) | 531 635 533 649 609 768 611 790 618 791 620 804 630 891 633 912 912 | Thyroidektomi når s-kalsitonin nivå er forhøyet eller i barnealder hvis foreldrene ikke ønsker regelmessig langvarig oppfølging som kan vare mange år
| Ved normal s-kalsitonin: Årlig analyse av s-kalsitonin.
Ved forhøyet s-kalsitonin: Thyroidektomi og sentral lymfadenektomi avhengig av ultralydfunn og s- kalsitonin-nivå
| |
H (høy) | 634 | Thyroidektomi ved eller før 5 års alder basert på s- kalsitonin-nivå |
| |
HST (høyest) | 918 883 804 (Tandem) | Thyroidektomi så tidlig som mulig og helst i første leveår. Thyroidektomi må gjøres før 4 års alder for å oppnå kurasjon. |
|
|
Ved MEN2 utvikles MTC via neoplastisk c-celle-hyperplasi (hyperplasi-karsinom-sekvens) (Chernock et al., 2015; Yadav et al., 2018). Det er en kontroversiell diskusjon om sporadiske MTC også utvikler seg via c-celle-hyperplasi eller de-novo. Omvendt er det ukjent om pasienter med sporadisk c-celle-hyperplasi har en risiko for å utvikle MTC.
Utredning
I tillegg til konvensjonell utredning med ultralyd hals og finnålsbiopsi, er biokjemisk utredning ved MTC svært viktig. Som sensitive tumormarkører brukes serum- kalsitonin og CEA. S-kalsitonin har vist seg å være et veldig sensitivt verktøy for diagnostikk. I tillegg er det relasjon mellom s-kalsitonin-nivå og utbredelse av sykdom (sannsynlighet for lymfeknute- og fjernmetastaser), selv om det ikke alltid er lineær sammenheng her (Machens et al., 2010; Opsahl et al., 2019a). Målemetoden for kalsitonin har blitt ultrasensitiv og stimulerte kalsitoninverdier vil i de fleste tilfeller ikke gi mer informasjon om sykdommen (se kapittel 5.3).
Halveringstiden for s-kalsitonin er 3-30 timer (Fugazzola et al., 1994). Grunnet døgnvariasjoner i kalsitoninutskillelse fra cellene, vil kalsitonin verdiene fluktuere uten at det trenger å forekomme sykdomsprogresjon. Allikevel, der det er stigning i s-kalsitonin-nivå er det naturlig å kontrollere dette med en raskere kontroll (3-6 mnd.). Ved reell stigning er det tegn til sykdomsprogresjon (lokalt residiv, lymfeknute eller fjernmetastaser).
S-kalsitonin analyseres ved Oslo Universitetssykehus (OUS) Radiumhospitalet og ved Haukeland Universitetssykehus (HUS). Der blodprøven må sendes for analyse er det viktig å påse at prøven sendes frosset.
CEA er en integrert del av cellemembranen til MTC tumor celler og kan dermed tjene som tumormarkør, men den er mindre spesifikk og forhøyete verdier kan forekomme ved en rekke andre kreftformer (Bümming et al., 2008; Osamura et al., 1997).
Kontrast-CT eller MR av hals, thorax og abdomen eller alternativt FDOPA-PET/CT eller 68G-DOTATOC PET/CT bør vurderes ved høye s-kalsitonin verdier for å utelukke mediastinale metastatiske lymfeknuter og fjernmetastaser. ATA anbefaler metastaseutredning ved s-kalsitonin-nivå over 150 pmol/L (500pg/mL) (Wells et al., 2015). Ved residiv har FDOPA PET/CT høyest sensitivitet (Treglia et al., 2023). Et flytskjema for utredning av MTC er angitt i bilde 5.
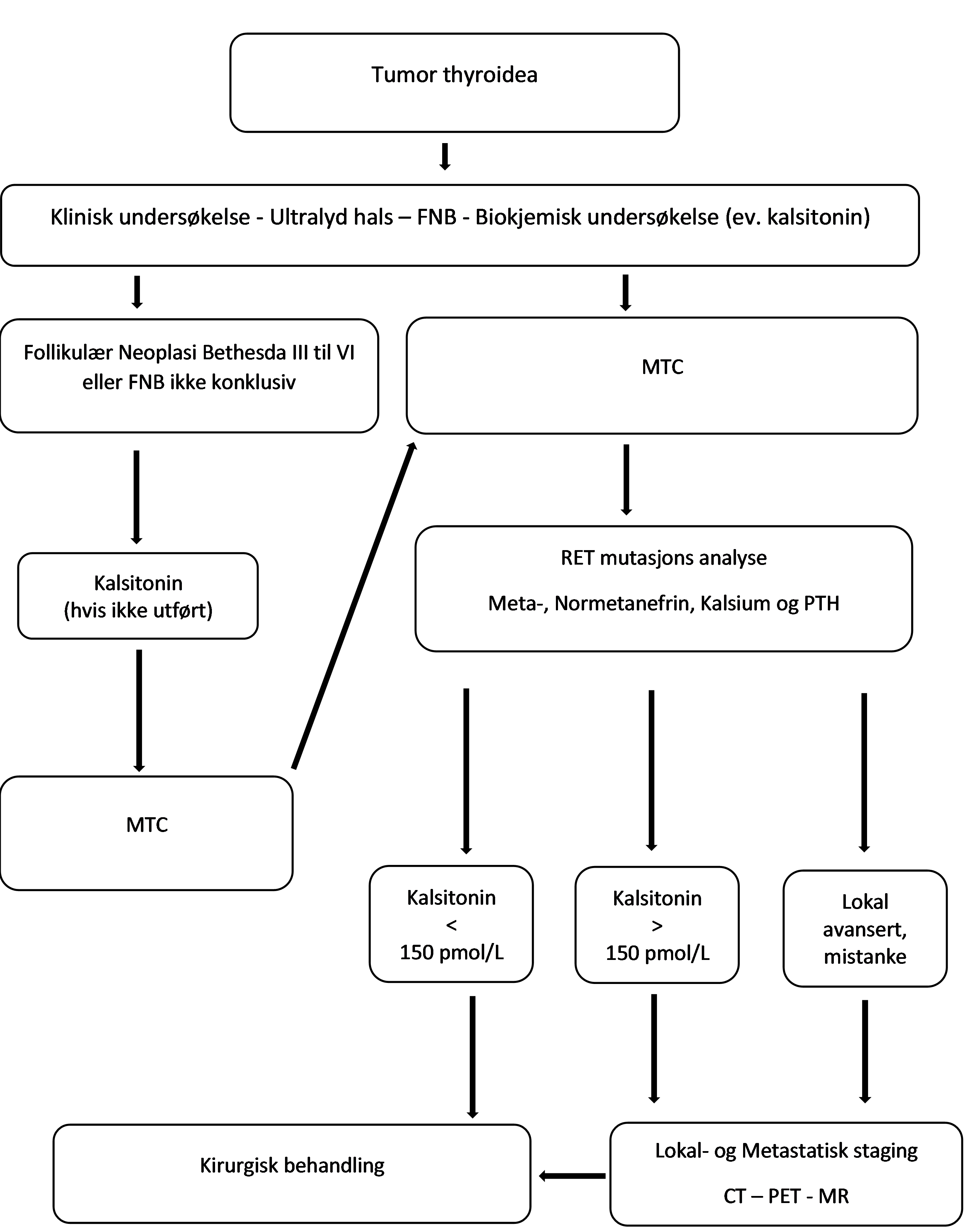
Egenprdousert av arbeidsgruppen basert på data fra Wells et al. (2015).
Pasienter med MEN2A har mutasjons- og aldersavhengig risiko for primær hyperparathyroidisme (pHPT) og feokromocytom (Eng et al., 1994; Kebebew et al., 2000; Pelizzo et al., 2007). Begge tilstander må utredes i forkant av operasjon for MTC. Ved PHPT må operasjonsstrategien i halsen tilpasses, ved feokromocytom må binyreoperasjonen utføres før halsoperasjonen. Feokromocytom må også utelukkes preoperativ hos pasienter med MEN 2B (pHPT er ikke en del av dette syndromet). Dersom RET proto-oncogene ikke har blitt analysert før operasjonen eller det mangler svar, må p-metanefrin, p-normetanefrin, s-kalsium og PTH analyseres for å utelukke feokromocytom og PHPT. Feokromocytom må være utelukket før planlagt operasjon eller invasive prosedyrer. Det er obligat å tilby analyse av RET proto-oncogene til alle pasienter med MTC, men svaret skal ikke forsinke operasjon.
Kirurgisk behandling
Kirurgisk behandling er eneste kurative behandling. Det er derfor svært viktig med god utredning og nøyaktig kirurgi med mikrodisseksjonsteknikk i tilstrekkelig omfang ved første operasjon.
Operasjonsomfang ved primæroperasjon
Sporadisk MTC er vanligvis unifokal og unisentrisk. Hos pasienter med sporadisk MTC, biokjemisk og billedmessig uten lymfeknute- eller fjernmetastaser, og der primærsvulst er < 2 cm kan hemithyroidektomi med unilateral sentral lymfadenektomi vurderes å være tilstrekkelig (Wells et al., 2015). Arvelig MTC må da være utelukket med negativ mutasjonsanalyse før operasjonen. Grunnet økende billeddiagnostikk og sensitive kalsitoninanalyser brukt i utredningen av knuter i thyroidea, vil en oppdage MTC tidlig i forløpet hos noen pasienter.
Standardomfanget av operasjon er total thyroidektomi med sentral lymfadenektomi både ved sporadisk og familiær MTC. Terapeutisk lymfadenektomi i laterale halsfelt utføres ved påviste metastatiske lymfeknuter og bør utføres som systematisk og kompartment-orientert fjerning av alt bløtvev (lymfeknuter og fettvev) med mikrodisseksjonsteknikk (se avsnitt "Differensiert thyroideakarsinom – risikostratifisering og kirurgi"). Terapeutisk mediastinal lymfeknutedisseksjon bør vurderes ved mediastinale lymfeknutemetastaser. Mediastinale lymfeknutemetastaser bør fjernes hvis disse truer å infiltrere viktige organer, og pasientene befinner seg i en stabil sykdomssituasjon.
Siden helbredelse hittil kun oppnås med kirurgi, bør profylaktisk lateral cervikal lymfadenektomi vurderes der det er mistanke om mikroskopisk sykdom i det laterale halsfelt. Det er ikke konsensus om dette internasjonalt, og det er også kontroversielt om det i så fall bør utføres kun ipsilateral lateral eller bilateral lateral cervikal lymfadenektomi (Machens et al., 2010; Opsahl et al., 2019a; Wells et al., 2015). Omfanget bør bestemmes av s-kalsitoninnivå, diameter og utbredelse av primærtumor, metastasebyrde i det sentrale halsfelt og i samråd med pasienten. Det anmerkes at det ikke foreligger entydige «cut-off» verdier for s-kalsitoninnivået. I beslutningen bør en informere pasienten nøyaktig om komplikasjoner ved lateral cervikal lymfadenektomi. For å unngå unødvendig kirurgi kan en eventuell framgangsmåte være å operere i to seanser (van Beek et al., 2021). Det utføres total thyroidektomi med sentral lymfadenektomi først. Pasienter med persisterende forhøyet kalsitonin postoperativt, og hvor det billedmessig (ultralyd, CT, MR eller PET/CT) ikke foreligger fjernmetastaser, vurderes for profylaktisk lateral cervikal lymfadenektomi. Samtale og avgjørelse som dette må tas i samvalg med pasienten.
Første postoperative kontroll med måling av s-kalsitonin, CEA og gjennomgang av histologi (se avsnitt 5.10) skal foretas 6-8 uker postoperativt. En vil da kunne beslutte videre framgangsmåte ved persisterende hyperkalsitoninemi.
Profylaktisk mediastinal lymfadenektomi er ikke indisert.
Pasienter med kjent metastatisk sykdom som ikke er resektabel ved diagnosetidspunktet, bør vurderes for cervikal kirurgi. Metastaser kan vokse langsomt og det er viktig å få lokal kontroll cervikalt. Disse pasientene vil sannsynligvis ha nytte av kirurgi og kan oppleve langvarig stabil sykdom (Zhuang et al., 2021).
Kompletterende kirurgi
Hos pasienter med tilfeldig funn av MTC etter diagnostisk hemithyroidektomi må en genetisk bakgrunn utelukkes. Fullstendig RET proto-oncogen analyse er da obligatorisk. Pasientene anbefales kompletterende kirurgi, til total thyroidektomi, hvis RET gen mutasjon er påvist. Ved negativ RET mutasjonsanalyse kan pasientene vurderes for kontroll uten kompletterende kirurgi hvis følgende kriterier foreligger: 1) histologisk intrathyroidal tumor 2) normal postoperativ s-kalsitoninverdi. Det er allikevel ikke nok data for å gi klare anbefalinger her, slik at avgjørelse om kompletterende kirurgi må tas på individuell basis. Pasienten bør informeres og ha gitt samtykke til fremgangsmåten.
Etter utført total thyroidektomi er det verken ved sporadisk eller familiær MTC indikasjon for ytterligere operasjon dersom basal s-kalsitonin er under nedre deteksjonsgrense. Omfanget av cervikal lymfadenektomi bør bestemmes avhengig av basal s-kalsitonin nivå og preoperativ bildediagnostikk, jfr. ovenfor.
Pasienter med insidentelt funn av MTC bør henvises til regionsykehus for videre vurdering og oppfølging.
Kirurgi ved residiv
Ved cervikalt residiv er det stort sett alltid indikasjon for ny kirurgi siden infiltrasjon av nerver, kar, trachea eller øsofagus kan bli livstruende. Hittil ikke opererte kompartment bør fjernes fullstendig i ovennevnte teknikk. Ved residiv i primæropererte kompartment kan selektiv tumorreseksjon vurderes. Før beslutning om residivkirurgi bør pasienten utredes med tanke på fjernmetastaser og beslutningen må gjøres på individuell basis i et multidisiplinært team og i samråd med pasienten. Hos pasienter med fjernmetastaser er det ikke indisert med ekstensiv kirurgi på halsen, men kun fjerning av store metastaser som gir plager og er lokalt truende (Moley, 2010; Wells et al., 2015). Det er større komplikasjonsrisiko ved residivkirurgi.
Lokalavansert medullært thyroideakarsinom
Ved MTC med invasjon i nerver, kar, trachea eller øsofagus, bør en utvidet reseksjon vurderes hos pasienter som er i god allmenntilstand uten påvisbare fjernmetastaser, eller i utvalgte tilfeller ved fjernmetastaser, men med stabile s-kalsitoninverdier og antatt stabil sykdom. Vurderingen vil være avhengig av infiltrasjonsgrad og i samråd med pasient. Kasuistikker hvor pasienter ble neoadjuvant behandlet med selektive RET-hemmere og deretter operert er lovende, men foregår kun ved inklusjon i studier (Contrera et al., 2023).
Profylaktisk kirurgi
DNA-basert screening (RET kimebanemutasjoner) muliggjør profylaktisk kirurgi hos personer før MTC oppstår. Målet med profylaktisk halskirurgi er å forhindre MTC utvikling, men aller viktigst er det å fjerne thyroidea før sykdommen har spredt seg til lymfeknuter eller andre steder.
RET-mutasjonen bestemmer aldersavhengig risiko for å utvikle MTC (genotype-fenotype –korrelasjon), men er ikke nøyaktig nok til å forutsi når malignt transformasjon skjer hos hver enkelt. Man har derfor gått vekk fra den kun mutasjonsbaserte risikovurderingen for operasjonstidspunkt og bruker s-kalsitonin som markør (Wells et al., 2015) (Tabell 9). Så lenge s-kalsitonin-nivået er normalt, foreligger det ikke MTC. Når s-kalsitonin stiger til øvre grenseområde eller er lett forhøyet, er utvikling av MTC nært forestående og det anbefales total thyroidektomi. Hvis s-kalsitonin er patologisk forhøyet, bør i tillegg cervikal sentral lymfadenektomi utføres. Det er funnet metastatiske lymfeknuter ved s-kalsitoninnivå ned til 6 pmol/l (Machens et al., 2010; Raue et al., 2018; Rohmer et al., 2011). Å terminere operasjon at man kan unngå sentral lymfadenektomi, vil redusere risikoen for postoperativ hypoparathyroidisme.
MEN2 genbærere bør følges hos endokrinkirurg både med tanke på MTC, PHPT og feokromocytom. Det er viktig å vite at normalverdier for serum-kalsitonin er høyere i de første leveårene og derfor vanskeligere å tolke. Tett samarbeid med laboratoriene (HUS og OUS) er en forutsetning.
Hos barn, og da spesielt hos neonatale barn, er det i litteraturen rapportert referanseverdier opp til 11,7 pmol/L (40 pg/ml). En studie som inkluderte 6090 serumprøver fra 2639 barn og omfattet nyfødte og barn opp til 5 års alder, viste bratt nedgang i s-kalsitoninnivåene med alderen (Eckelt et al., 2019). Det var høyere normalverdier hos gutter enn hos jenter. Studien presenterte kalsitonin referanseverdier hos barn fra 3 måneder til 18 år, og høyeste normale kalsitoninverdi var 21,3 pmol/L (72,7 pg/mL) hos et 3 måneder gammel barn.
Anaplastisk thyroideakarsinom
ATC er den mest aggressive og hurtigvoksende solide tumor i thyroidea. Den vokser raskt lokalt på halsen, gir hyppig rekurrensparese og pustebesvær. ATC klassifiseres som de andre tumores etter TNM, imidlertid gjelder for ATC en annen UICC stadiet inndeling (alle er UICC stadium 4) (se kapittel 5.10). Fjernmetastaser opptrer gjerne initialt eller innen få måneder. De fleste ATC er lokalavanserte (T4b) ved diagnosetidspunkt, og nesten ingen helbredes uansett terapeutisk tilnærming. Median levetid er under ett år til tross for multimodalt terapikonsept (Bisof et al., 2015). Hos de få som helbredes foreligger det gjerne et lite, intrathyroidal fokus av ATC i en struma eller et DTC (T4a).
Pasienter med mistanke eller påvist ATC skal henvises til regionsykehus med et multidisiplinært team. Rask utredning og diagnosestilling kan være avgjørende. Innleggelse skal tidlig vurderes med tanke på rask utredning, tids nære oppstart av behandling og med tanke på truende luftvei. Ved ren palliativ tilnærming er det ønskelig at pasienten kan får behandling nært hjemme.
Det skal tidlig involveres onkolog og et palliativt team. Pasienten skal undersøkes av ØNH lege best med fiberoptisk laryngoskopi for bedømmelse av stemmebåndsfunksjon, subglottis og øvre trachea (Smallridge et al., 2012). Lokal kontroll er viktig på grunn av symptomer og livskvalitet.
Resektabilitet ved ATC ansees når det kan oppnås makroskopisk frie marginer (R1-reseksjon). Dersom det foreligger resektabel tumor er total thyroidektomi med profylaktisk eller terapeutisk sentral lymfadenektomi standardoperasjon (Smallridge et al., 2012). Ved lymfeknutemetastaser i de laterale kompartmentene skal lateral lymfadenektomi vurderes, men ofte reflekterer denne situasjonen inkurabilitet. Det er ikke indikasjon for omfattende reseksjon som innebærer laryngektomi eller reseksjon av arteria carotis interna. Hos risikopasienter kan det være en fordel å redusere operasjonens omfang til reseksjon av den tumorbærende thyroidealappen (hemithyroidektomi). Tumorvolum-reduserende kirurgi («debulking») har ingen effekt på prognosen og er ikke indisert.
Tett samarbeid i et multidisiplinært team er forutsetning og det vises til flytskjema «Multimodal behandling» (Bilde 1)
Krav til operasjonsbeskrivelse
Operasjonsbeskrivelsen må inneholde en kort beskrivelse av indikasjonen og at pasienten er informert både om indikasjon, ev alternative behandlingsmuligheter og om operasjonsrisiko. Spesielt risiko for stemmebåndsnerveskade og postoperativ nedsatt parathyroideafunksjon inkludert sjeldne komplikasjoner som blødning eller infeksjon. Pasienten bør være informert om ev nødvendig livslang tyroksinsubstitusjon.
Diagnosen og prosedyren bør eksakt angis sammen med riktig koding.
Bruk av spesielt utstyr (for eksempel ultralydsaks, andre spesielle disseksjonshjelpemidler, nervemonitorering, autofluorescense) bør nevnes.
Operasjonsbeskrivelsen skal inneholde en kort beskrivelse av den anatomiske situasjonen (tumorlokalisasjon, tumorstørrelse, infiltrasjon av andre organer, suspekte lymfeknuter) i tillegg til anatomiske varianter. Hele operasjonen bør beskrives i alle relevante aspekter. Ved vanskelig eller tidkrevende disseksjon bør dette anføres. Særlig håndteringen av nervene (minst nervus laryngeus rekurrens, nervus vagus og nervus laryngeus superior) og parathyroideakjertlene må beskrives. Når det gjelder parathyroidea bør det gis informasjon om hvor mange som ble funnet/bevart/ autotransplantert/merket/biopsert. Med hensyn til nervene skal det beskrives på hvilken måte nervene ble identifisert og hvor. Ved bruk av nervemonitorering bør resultatene og teknikk angis.
Operasjonsomfang må beskrives. Ved lymfadenektomi skal operasjonsbeskrivelsen gi nøyaktig informasjon om omfanget og intraoperative funn.
Operasjonsresultatet må angis for eksempel makroskopisk radikal/ikke radikal operasjon.
Intraoperative komplikasjoner må nevnes.
Det bør angis på hvilken måte hemostase ble utført (for eksempel bruk av hjelpemidler), om dren er innlagt og på hvilken måte halsen ble lukket.
Operasjonsbeskrivelsen bør også inneholde postoperative beskjeder i tilfellet slike gis.
Håndtering av operasjonsmaterialet
Remissen må inneholde kliniske opplysninger og evt. spesielle problemstillinger. Kirurgen må merke preparatene for eksempel med sutur i øvre thyroideapol. Operasjonspreparatet bør i minst mulig grad være skåret i. Spesielle lesjoner bør merkes med sutur og beskrives i remissen. Lymfeknuter kan med fordel monteres på isoporplate, og ulike grupper og lymfeknutestasjoner markeres.
Profylakse og håndtering av komplikasjoner
Nerveskader
- Nervus recurrens (nervus laryngeus inferior)
- Nervus laryngeus superior (ramus externus)
- Nervus accessorius
- Nervus hypoglossus
- Nervus phrenicus
- Truncus sympathicus
Prinsipielt gjelder at nervene bør fremstilles og identifiseres hvis det dissekeres i nærheten av dem.
Dette gjelder særlig nervus recurrens både ved thyroidektomi og sentral lymfadenektomi. Under operasjonen skal nervus recurrens aktivt identifiseres visuelt ved forsiktig disseksjon. Identifikasjon inferiort for thyroidea kan være sikrest fordi nerven kan dele seg i flere grener. Også kapselnær disseksjon uten visuell identifikasjon kan medføre nerveskade, spesielt ved cancer.
Alle pasienter skal undersøkes preoperativt med laryngoskopi for å dokumentere stemmebåndsfunksjonen, og om nødvendig intraluminale forhold. Nedsatt stemmebåndsfunksjon preoperativt kan gi mistanke om invasiv voksende tumor. Postoperativ laryngoskopi skal utføres ved preoperativ påvist patologi, tap av nervemonitorering signal intraoperativt (dvs. amplitude på nervus vagus < 100mA) eller hes stemme. Profesjonelle stemmebrukere (spesielt sangere) bør undersøkes med stroboskopisk laryngoskopi.
Intraoperativ nervemonitorering anbefales ved kreftkirurgi (Nasjonale råd Kreftkirurgi). Intraoperativ nervemonitorering kan være til hjelp for å identifisere nerven. Selv om det ikke er vist at rutinemessig nervemonitorering bedrer resultatene ved primæroperasjon, gjør det at man kan verifisere den visuelle identifikasjonen av nerven, og gjør disseksjonen lettere om det er vanskelig anatomi på grunn av primærtumor eller sentrale lymfeknutemetastaser. Det kan være særlig nyttig ved total thyroidektomi og ved residivkirurgi. Ved riktig bruk av intraoperativ nervemonitorering kan den postoperative stemmebåndsfunksjonen ganske nøye predikeres. Intraoperativ signaltap kan påvirke operasjonsstrategien i tilfellet det påvises nerveskade etter utført første side (for eksempel utsette side nr. 2 til nerven har fått normal funksjon tilbake, vurdere andre behandlingstilnærminger ved permanent nerveskade i MDT møte). Videre ansees intraoperativ nervemonitorering som meget nyttig når det foreligger tumorinfiltrasjon av nerven og intraoperativ avgjørelse om nervereseksjon må gjøres. Det vises til omfattende beskrivelse i henhold til bruk og vurdering av intraoperativ nervemonitorering til anbefalinger fra International Neural Monitoring Study Group (Schneider et al., 2018; Wu et al., 2018). For sikker tolkning og håndtering av nervemonitorering, anbefales det brukt regelmessig.
Kontinuerlig nervemonitorering av nervus vagus kan være til hjelp særlig ved krevende preparasjoner (adherent nerve, store tumores) med hensyn på om truende nerveskader kan oppdages så lenge de er reversible.
Nervus laryngeus superior (ramus externus) har variabelt forløp i forhold til øvre thyroideapol. Det er usikkert om generell identifisering av denne nerven vil ha fordeler. Ved ligatur av arteria thyroidea superior og mobilisering av øvre thyroideapol, bør man imidlertid forsikre seg om at nerven ikke blir skadet (Barczyński et al., 2013b).
Ved sentral og lateral lymfadenektomi bør nervus accessorius, nervus hypoglossus, nervus phrenicus og truncus sympathicus bevares. Dette forutsetter vanligvis at disse nervene identifiseres.
1. Ensidig rekurrensskade
Rekurrensskade defineres som nedsatt ab- og adduksjon av ipsilaterale stemmebånd. Stemmebåndet vil da vanligvis innta en paramedian eller intermediær stilling. Dette gir ufullstendig lukking av stemmespalten og dysfoni, dårlig motstand ved hosting, aspirasjonstendens og tale- og anstrengelsesdyspnoe. Stemmen blir klangfattig med luftlekkasje og redusert toneregister. Stemmen kan postoperativt være relativt normal, men ved tiltagende atrofi av denervert muskulatur blir problemene mer fremtredende. Sjeldnere er stemmebåndet i median stilling hvilket gir dyspne, men mindre stemmepåvirkning.
Reanastomosering av nervus recurrens ved reseksjon for tumorinvasjon gir ikke funksjon tilbake, men kan gi økt muskeltonus og redusert atrofi av stemmebåndet.
Ved verifisert skade bør pasienten oppmuntres til å bruke stemmen. Stemmehvile er uhensiktsmessig. Samtidig skal pasienten henvises til logoped for å forebygge feil bruk av ekstern larynxmuskulatur (kompensatorisk). Mindre enn halvparten av pasientene får spontan bedring av stemmebåndsfunksjonen. Tidlig injeksjonsbehandling kan vurderes.
Er det fortsatt paralyse med nedsatt stemmekvalitet etter ett år, bør pasienten vurderes med tanke på kompensatorisk kirurgi. Økt støtte og fylde i stemmebåndet kan oppnås ved implantasjon av fettvev, injeksjon (hydroxylapatite eller hyaluronsyre) eller protese (thyroplastikk). Medialisering av stemmebåndet kan gi bedre lukning av stemmespalten og øke stemmekvaliteten.
2. Bilateral rekurrensskade
Ved bilateral rekurrensskade er symptomene avhengig av stemmebåndenes stilling. Stemmen er desto bedre jo nærmere stemmebåndene står midtlinjen, men samtidig blir dyspne mere uttalt. Ved postoperativ stridor må reintubasjon eller trakeotomi vurderes. Ved vedvarende bilateral paralyse kan bakre kordektomi (ekstirpasjon av bakre del av stemmebåndet) redusere stridor og dyspne, men vil samtidig gi dårligere stemmefunksjon. For disse pasientene er stemmetrening hos logoped indisert.
3. Skade av nervus laryngeus superior
Skade på nervus laryngeus superior (som innerverer musculus cricothyroideus (hjelper med å addusere og stramme stemmebåndet)) kan gi lavere toneleie og reduserer øvre del av toneregisteret. Sensoriske fibre er viktige for beskyttende reflekser, og skade kan gi aspirasjonstendens.
Anamnese og stroboskopisk laryngoskopi med påvisning av økt glottisbølgeamplitude gir gode holdepunkt for diagnosen.
4. Skade av nervus accessorius
Skade av nervus accessorius gir hengende skulder og problemer med å løfte armen over horisontalplanet i rett lateral eller bakre stilling på grunn av parese av musculus trapezius. Ved kraniolateral lymfadenektomi skal nerven aktivt identifiseres. Intraoperativ nervemonitorering kan være til hjelp. Differensiert thyroideakarsinom gir sjelden grunn for å ofre nerven. Nedsatt funksjon kan allikevel forekomme og er lett å identifisere umiddelbart postoperativt. Ved omfattende arrdannelse kan gradvis redusert funksjon inntre. Skulderøvelser er viktige for å opprettholde mest mulig av skulderfunksjonen og pasienten bør henvises til fysioterapeut.
5. Skade av truncus sympathicus
Skade av sympatiske grensestreng kan gi Horners syndrom. Ved uttalte symptomer kan pasientene henvises til øyelege til vurdering av øyelokk-kirurgi.
6. Skade av nervus hypoglossus
Skade av nervus hypoglossus kan opptre etter submandibulær disseksjon, og er oftest forbigående. Ved permanent skade bør pasientene vurderes av ØNH lege.
Hypokalsemi
Hypokalsemi postoperativt kan være forbigående eller permanent. Årsakene kan være operasjonstraumet i seg selv med ødem i området den første tiden etter operasjonen, skadet eller midlertidig nedsatt karforsyning til parathyroidea, eller at parathyroideakjertlene har blitt med i resektatet.
Etter total thyroidektomi er det ikke uvanlig med lette hypokalsemi-symptomer en kort periode. Insidensen av permanent postoperativ hypokalsemi ligger på ca. 2-10 % avhengig av kirurgens erfaring og tumorens utbredelse og øker med utført sentral lymfadenektomi (Reinke et al., 2023; Salem et al., 2021).
Også ved reoperasjon er risikoen for postoperativ hypokalsemi betydelig økt, og det er også av den grunn viktig at det første inngrepet er så radikalt som nødvendig.
Dersom kirurgen ser at en parathyroideakjertel er devaskularisert eller har blitt med reseksjonspreparatet ut, bør parathyroideakjerteln autotransplanteres. En slik finsnittet, transplantert kjertel vil vanligvis gjenoppta sin funksjon i løpet av få uker til 2–3 måneder. Vanligvis implanteres vevet i en lomme i musculus sternocleidomastoideus. Lommen bør merkes med ikke resorberbar tråd. Ved MEN1 med betydelig risiko for å utvikle senere hyperparathyroidisme bør transplantasjonen foretas i underarmen.
Disseksjonen i det sentrale kompartment bør gjøres forsiktig med hensyn til parathyroideakjertlene og deres blodforsyning. Det er kontroversielt om kjertlene bør aktivt identifiseres. Om man ikke finner kjertlene på vanlig sted og man er sikker på at kjertlene ikke er med i reseksjonspreparatet, er det er ikke anbefalt å lete etter eventuelt ektopisk lokaliserte kjertler.
Bruk av intraoperativ near-infrared autofluorescense hjelper for bedre identifikasjon (flere kjertler visualiseres og færre fjernes aksidentelt), men studier kunne ikke vise effekt på permanent postoperativ hypoparathyroidisme raten (Bergenfelz et al., 2023; Kiernan et al., 2023; Lykke et al., 2023; Wolf et al., 2022).
Akutt hypokalsemi
Symptomer oppstår ofte de første postoperative døgnene, gjerne allerede få dager etter utført kirurgi, og kan omfatte stikninger og nummenhet i ekstremitetene og ansiktet, og kramper særlig i de små musklene (tetani). Akutt postoperativ hypokalsemi er ofte en skremmende og traumatisk opplevelse for pasienten. Det er imidlertid ikke streng korrelasjon mellom s-kalsium og symptombilde, og mange pasienter med lavt s-kalsium er klinisk asymptomatiske. Profylaktisk substitusjon av både kalsium og vitamin D bør vurderes i forhold til den intraoperative situasjon.
Pasienten må derfor informeres om risikoen for å kunne få hypokalsemi etter operasjonen, og kunnskap om symptomene på lavt s-kalsium, klinisk observasjon og daglig måling av s-kalsium er nødvendig. Måling av PTH intra- eller postoperativt kan være nyttig for å kunne vurdere videre forløp.
Vær oppmerksom på at fritt kalsium bør måles framfor total-kalsium hos pasienter med kalsiumforstyrrelser. Total-kalsium er upålitelig ved større avvik i albuminnivå eller syre-base-status. Albuminkorrigert kalsium er ikke mer presist enn total-kalsium.
Det er ikke konsensus med hensyn til når substitusjonsbehandling bør startes ved asymptomatiske pasienter. Indikasjonen er klar ved symptomer. Oral kalsiumsubstitusjon bør foretrekkes. Ved lavt s-kalsium kan det være en fordel å gi kalsium regelmessig gjennom døgnet, for eksempel kalsium (bruse-)tabletter á 500 mg 3 ganger per døgn. Det er liten risiko for overdosering med kalsiumtabletter, da pasienten vanligvis blir oppmerksom på symptomene på hypokalsemi og kan dosere seg selv for å holde symptomene borte. Det kan være en fordel å gi en fast dose med for eksempel 1(-2) g per døgn fordelt på 2(-4) doser og substituere videre etter behov.
Ved kraftige symptomer eller uttalt hypokalsemi (fritt kalsium < cirka 1,0 mmol/L, alternativt total-kalsium < cirka 1,9 mmol/L) som er refraktær på oral substitusjon, bør kalsium gis langsomt intravenøst. Gi f.eks. kalsiumglukonat 10%, 20 ml (4,6 mmol) injisert langsomt i.v. over 5-10 minutter ufortynnet i sentralt venekateter eller i stor perifer vene (maks injeksjonshastighet: 4 ml (0,9 mmol)/minutt i.v.). Dette kan gjentas ved behov etter 5 minutter. Deretter kontinuerlig infusjon: 0,3 mmol/kg over 6 timer. Vanlig infusjonshastighet er 3,3 mmol/time. Kan tilsettes 1000 ml NaCl 9 mg/ml eller glukose 50 mg/ml. Gjentas ved behov. Noen behøver kalsiuminfusjon gjentatt over flere døgn. Når tilstanden tillater det, bør man gå over til oral kalsiumtilførsel. Konsulter endokrinolog ved behov, og se gjerne Nasjonal veileder i endokrinologi, https://metodebok.no/index.php?action=topic&item=CZW7FZHV.
Dersom vitamin D-status ikke er sjekket eller korrigert før operasjonen, kan det ved uttalte symptomer gis engangstilskudd kolekalsiferol med f.eks. 50 000 IU. Ellers bør indikasjon for substitusjon med aktivt vitamin D vurderes individuelt. Det anbefales enten kalsitriol (0,5–1 μg per døgn) eller alfakalsidiol (1–2 μg per døgn), fordelt på to doser daglig. Ved behandling med aktivt vitamin D må pasienten også få peroralt kalsiumtilskudd (f.eks. 1 g daglig), men det trengs mindre peroralt kalsium enn om aktivt vitamin D ikke gis.
Ved lav serum-magnesium (<0,70 mmol/L) kan det gis peroralt tilskudd med magnesium 120 mg x 3. Ved alvorlig magnesium-mangel (s-Mg <0,5 mmol/L eller symptomer) kan en gi magnesium intravenøst (ved normal nyrefunksjon: MgSO4 0,5 mmol/kg/døgn i ½-1 liter glukose 50 mg/ml eller NaCl 9 mg/ml over minst 6 timer, se f.eks. Nasjonal veileder i endokrinologi, https://metodebok.no/index.php?action=topic&item=8U2WWNtL.
Kalsium- og vitamin D-tilskudd bør trappes ned gradvis. Det er viktig å ikke overbehandle. S-kalsium bør ligge ved nedre referansegrense.
Kontroll av kalsiumnivået i blodet (helst fritt kalsium, alternativt total-kalsium) bør gjennomføres med 2 ukers mellomrom inntil stabilt nivå. PTH bør måles hver 2. måned for å vurdere parathyroideafunksjonen. Er PTH målbar eller til og med i normalområdet og alle symptomer på hypokalsemi opphører, bør behandlingen forsøksvis stoppes, da parathyroideakjertlene kan være restituert.
Permanent hypoparathyroidisme
Forbigående postoperativ hypokalsemi bedres vanligvis i løpet av de første ukene til månedene. Dersom hypokalsemiproblemet fortsetter mer enn seks måneder, har pasienten fått permanent postoperativ hypoparathyroidisme. Da behøves livsvarig behandling med aktivt vitamin D, kalsiumtilskudd, vitamin D3 og eventuelt magnesiumtilskudd. Kontrollopplegget innebærer regelmessig oppfølgning av kalsiumstatus.
Basisbehandling er tilskudd med kalsium f.eks. 1 g daglig fordelt på to doser samt 800 IU vitamin D3 pr dag. I tillegg behøver pasienten oftest behandling med aktivt vitamin D, for eksempel kalsitriol (ofte 0,5–1 μg daglig) eller alfakalsidiol (ofte 1–2 μg daglig) fordelt på to daglige doser. Oppstart av potent aktivert vitamin D bør foregå med langsom doseøkning fra laveste anbefalte dose, hvis man ikke har tidligere doser å støtte seg til. Det tilstrebes s-Mg >0,80 mmol/L, og daglig peroralt magnesiumtilskudd med 120 mg x 3 eller mer kan være nødvendig (dosen kan måtte begrenses av diaretendens og nyrefunksjon). Tillegg av tiaziddiuretikum kan være aktuelt ved høy kalsiumutskillelse i urinen. Se også kapittel om hypoparathyroidisme i Nasjonal veileder i endokrinologi for ytterligere detaljer: https://metodebok.no/index.php?action=topic&item=v62iPeJs.
Ved behandling med aktivt vitamin D og kalsium bør kalsiumnivået i blodet (helst fritt kalsium, alternativt total-kalsium) ligge omkring eller like under nedre referansegrense for å unngå konkrementer i urinveiene pga. hyperkalsiuri og nefrokalsinose med påfølgende nyresvikt. Fosfat bør være under øvre referansegrense. Det er ofte bedre å redusere på kalsiuminntaket enn dosen aktivt vitamin D hvis kalsium-nivået er over målområdet.
Når behandlingen er velinnstilt, kontrolleres fritt kalsium (alternativt total-kalsium), fosfat, magnesium, kreatinin og 25-OH-vitamin D hver 3.-6. måned. I tillegg bør urinutskillelsen av kalsium i døgnurin eller spoturin kontrolleres regelmessig (årlig, oftere ved forhøyet utskillelse eller behandlingsjusteringer). Se også kapittel om hypoparathyroidisme i Nasjonal veileder i endokrinologi for ytterligere detaljer: https://metodebok.no/index.php?action=topic&item=v62iPeJs.
Pasienten kan utstyres med et kort med informasjon om nødvendig akuttbehandling av hypoparaparathyreoidisme. Registeret for organspesifikke autoimmune sykdommer (ROAS) ved Haukeland universitetssjukehus har laget et slikt kort med norsk og engelsk tekst.
Blødning
Blødninger etter thyroideakirurgi kan bli livstruende og må behandles umiddelbart med reoperasjon. Sykehus som driver thyroidea kirurgi må ha en faglig beredskap til å håndtere dette, både mht. kirurg og anestesi. Det vises til Nasjonale faglige råd kreftkirurgi. Blødning gjør operasjonsfeltet uoversiktlig og medfører risiko for skade på rekurrensnerve og parathyroidea.
Infeksjon
Dyp infeksjon kan være en farlig komplikasjon med risiko for mediastinitt og erosjonsblødning. Antibiotika gis, og tidlig operativ sårrevisjon bør vurderes.
Chyluslekkasje
Særlig ved lateral lymfadenektomi inferiort på venstre side (nivå IV) kan det komme lekkasje fra ductus thoracicus der den munner inn i venevinkelen mellom vena jugularis interna og vena subclavia. Erkjennes dette intraoperativt kan man lukke den med clips eller forsiktig suturering, gjerne med dekning av muskulatur eller injeksjon av fibrin lim i ductus.
Ved postoperativ lekkasje kan det forsøkes behandlet med lokal kompresjon og passivt dren. Effekt av diett er usikker. Octreotid kan prøves, men det foreligger ikke evidens. Ved vedvarende fistel med volum >500 ml bør reoperasjon vurderes.