Definisjon
Obstipasjon (forstoppelse) er passasje av lite/hard avføring, sjelden og med vanskeligheter (De Graeff & Krol, 2009; Larkin et al., 2008). Pasienter som angir defekasjon mindre enn tre ganger per uke, eller som rapporterer smerte/ubehag i forbindelse med defekasjon, oppblåsthet eller en følelse av inkomplett tømning, bør undersøkes med tanke på obstipasjon (Larkin et al., 2008).
Obstipasjon ledsages ofte av ett eller flere av følgende symptomer:
- Utspilt/oppblåst abdomen
- Smerter, ubehag eller pressfornemmelse med diffus lokalisasjon i abdomen (viscerale smerter) og/eller anorektalt
- Allmennsymptomer: Dårlig matlyst, kvalme, oppkast, hodepine, vond smak i munnen, flatulens, rastløshet, konfusjon
- Hemoroider, analfissurer, perianale abscesser, urinretensjon
- Ev. paradoksal obstipasjonsdiaré, med eller uten inkontinens
Klinisk er det to aspekter som må tas hensyn til ved definisjon av obstipasjon hos palliative pasienter:
- Målbare symptomer: frekvens og karakteristika ved defekasjon
- Pasientens opplevelse: nivå av ubehag, endring i avføringsmønster
Etiologi og forekomst
>Obstipasjon forekommer hos 50–60 % av pasienter med langtkommet kreftsykdom, og hos nesten 90 % av dem som bruker opioider (Ahmedzai & Boland, 2010). Både generelle predisponerende faktorer (se tabell 4.5), «benigne» årsaker og direkte følger av kreftsykdommen, eller behandlingen av denne, kan forårsake obstipasjon.
Tabell 4.5
Predisponerende og forverrende faktorer ved obstipasjon (Locke, Pemberton, & Phillips, 2000; I. Mancini & Bruera, 1998; McMillan, 2004; Miles, Fellowes, Goodman, & Wilkinson, 2006; S. Smith, 2001; Woolery et al., 2008)
|
Obstipasjon oppstår enten på grunn av seigt eller hardt tarminnhold, eller på grunn av treg eller hindret tarmpassasje. Hos palliative pasienter er det ofte en kombinasjon av disse to mekanismene. Det er vanlig å skille mellom ikke-obstruktiv obstipasjon og obstruktiv obstipasjon, hvor sistnevnte har en mekanisk årsak. Det er av stor betydning å påvise en eventuell mekanisk årsak til obstipasjon, siden konservativ behandling i slike tilfeller ofte ikke vil føre til bedring.
Årsaker til ikke-obstruktiv obstipasjon
- Bivirkning av opioider. Ved påvirkning av µ-opioidreseptor i det submukosale plexus reduseres sekresjon, gastrointestinal motilitet og peristaltikk, samtidig som intestinalt væskeopptak økes (Ahmedzai & Boland, 2010).
- Bivirkning av cytostatika eller annen tumorrettet medikamentell behandling. Spesielt vinka-alkaloider, oxaliplatin og thalidomid.
- Bivirkning av andre medikamenter: antikolinergika (antidepressiva, antipsykotika og antiparkinsonmidler), serotoninantagonister, diuretika, antiarrytmika, antihistaminer, barbiturater, kalsiumblokkere, betablokkere, NSAIDs, antacida, jern og kalsium
- Nevrologisk tilstand, f.eks. slagsekvele, multippel sklerose, parkinsonisme, muskeldystrofier, medullakompresjon og ekspansive prosesser i sentralnervesystemet, paraneoplastisk autonom dysfunksjon
- Metabolsk sykdom, f.eks. hypothyreose, diabetes mellitus, Cushings syndrom, hyperparathyreoidisme, overvekt
- Metabolsk forstyrrelse, f. eks. dehydrering, hypokalemi, hyperkalsemi og uremi
- Primær idiopatisk obstipasjon, f.eks. colon inertia eller «slow transit constipation» og irritabel-tarm-syndrom
- Smertefull tilstand anorektalt (f. eks proktitt etter stråling, hemoroider, analfissurer)
- Sekundære faktorer: depresjon, demens, redusert matinntak, redusert væskeinntak, redusert inntak av fiber, inaktivitet, trøtthet, konfusjon, delir
Årsaker til obstruktiv obstipasjon
- Obstruerende svulster i tarm
- Svulster i bukhule/bekken som obstruerer tarm ved å komprimere den fra utsiden, f.eks. intraabdominale primærsvulster og/eller metastaser
- Godartet striktur i tarm, f.eks. fibrose etter strålebehandling, iskemiske anastomosestrikturer, strikturer forårsaket av adheranser og herniering, strikturer etter divertikulitter og iskemisk kolitt
- Godartet avløpshinder i bekkenbunnsområdet, f.eks. rektocele, slimhinneprolaps, intern herniering, megarektum, bekkenbunnsatrofi, sensibilitetstap i anorektalområdet eller bekkenbunns-dyssynergi («anismus»)
Utredning
Nøyaktig diagnostikk er nødvendig for valg av rett behandling og for forebygging (evidensnivå C). Det er generell enighet om at pasientens selvrapportering av obstipasjon er et utilstrekkelig mål (K. Clark & Currow, 2012). Det finnes flere spesifikke kartleggingsverktøy for vurdering av tarmfunksjon, men de fleste er tidkrevende å bruke, tar ikke hensyn til den underliggende normalvariasjonen i tarmfunksjon og baserer seg enten på kvantitative data eller pasientens selvrapportering. Svært få av dem er evaluert i palliative populasjoner, og ingen av dem er derfor på nåværende tidspunkt spesielt anbefalt (evidensnivå C). ESAS (Edmonton Symptom Assessment System), som allerede er mye brukt i palliasjon, har bevist sin nytte for å kunne bedre behandlingen av obstipasjon (Follwell et al., 2009). I revidert utgave av skjemaet inngår ikke obstipasjon som et eget spørsmål, men pasienten kan selv føre det på som et tiende problem. I EAPC grunnleggende datasett er obstipasjon tatt med.
Anamnese
Grundig anamneseopptak som inkluderer følgende (Larkin et al., 2008; Librach et al., 2010):
- Kvantitet og kvalitet av avføring
- Hvor mye? Hvor ofte? Mønster? Tidspunkt for forrige avføring?
- Konsistens? Farge? Lukt? Blod eller slim?
- Kontinent eller inkontinent?
- Endringer i tarmfunksjonen
- Hvordan var tarmfunksjonen før kreftsykdommen inntraff, og hvordan er den nå?
- Hvor ofte, hvor mye måtte pasienten presse tidligere. Endret avføringstrang?
- Smerter eller ubehag
- Har avføringstrang, men forhindres grunnet rektale smerter eller bevegelsesutløst smerte?
- Følelse av inkomplett tømning
- Avføringstrang også etter nylig toalettbesøk?
- Viktigheten av regelmessig tarmtømning for pasienten
- Angstsymptomer eller uro knyttet til nytt avføringsmønster?
- Ytre faktorer som påvirker avføringsmønsteret
- Toalettforhold
- Behov for hjelp til å komme til eller på toalettet
- Predisponerende og forverrende faktorer (se tabell 4.5 over)
- Andre sykdommer
- Medikamenter
Klinisk undersøkelse:
- Generell klinisk status
- Grundig undersøkelse av abdomen, rektum, bekkenbunn og analområde
- Abdomen: distensjon, synlig peristaltikk, økte tarmlyder, palpable oppfylninger, ascites ved perkusjon
- Rektum: sfinktertonus, faeces i ampullen, palpable tumores, hemoroider, analfissurer, dilatert rektum
- Vurdering av hydreringsstatus
Supplerende undersøkelser
Styres ut fra anamnese og klinisk undersøkelse.
- Blodprøver: Hb, Na, K, kreatinin, FT4, TSH, total og ionisert Ca, fosfat, albumin og glukose
- Røntgenundersøkelser: Røntgen oversikt abdomen eller CT for påvisning av intraabdominale tumormasser. Kontrastundersøkelser gjøres i dag kun på spesiell indikasjon og eventuelt etter CT
- Endoskopi (rektoskopi, koloskopi) for diagnostikk og ev. endoskopisk behandling av distal obstruksjon
Forebygging
Siden obstipasjon er hyppig forekommende og svært belastende, bør vår holdning være aktivt forebyggende. Det er spesielt viktig å forebygge i tilfeller hvor det foreligger kjente predisponerende faktorer, eller der det benyttes medikamenter med klart obstiperende virkning, først og fremst opioider. Det er en kunstfeil å forskrive opioider uten samtidig å starte medikamentell obstipasjonsprofylakse (unntak er pasienter med en kronisk diarétilstand eller ileostomi, samt døende pasienter).
Målsettingen er først og fremst å forebygge konsekvensene av obstipasjon (f. eks abdominal distensjon, smerter, kvalme/oppkast, hemoroider, analfissurer etc). Det er som regel urealistisk å oppnå samme avføringsmønster som før sykdommen inntraff. Bevisstgjøring/opplæring av pasienten, kostholdsråd og ikke-farmakologisk intervensjon er minst like viktig som medikamentell behandling (evidensnivå C) (De Graeff & Krol, 2009). Følgende tiltak vurderes og eventuelt iverksettes:
- Økt væskeinntak og behandling av dehydrering. Minimum 1,5 liter væske daglig (evidensnivå C) (De Graeff & Krol, 2009; Larkin et al., 2008).
- God smerte- og symptomlindring, inkludert ivaretakelse av pasientens psykiske helse. Dette vil fremme fysisk funksjon og ofte bedre næringsinntaket.
- Adekvat næringsinntak så sant det er mulig.
- Kostholdsråd (fibertilskudd, fruktblandinger), men merk at det for de fleste pasienter kreves en betydelig økning i fiberinntak for å oppnå effekt. Fibertilskudd alene hos obstiperte kreftpasienter regnes som inadekvat behandling (evidensnivå C) (De Graeff & Krol, 2009; Larkin et al., 2008).
- Økt fysisk aktivitet (evidensnivå C) (De Graeff & Krol, 2009). Vurder fysikalsk behandling.
- Korrigering av elektrolyttforstyrrelser (hypokalemi, hyperkalsemi) og hyperglykemi.
- Behandling av eventuell depresjon: samtale- og/eller farmakoterapi.
- Om mulig seponering av obstiperende medikamenter (f. eks antikolinergika) (evidensnivå B) (K. Clark, Lam, Agar, Chye, & Currow, 2010).
- Tilrettelegging av toalettforhold, inkludert hjelpemidler. Pasienter anbefales å bruke toalettet 20 min etter frokost (evidensnivå C). Bekken i sengen bør unngås (evidensnivå C) (Librach et al., 2010)
- Medikamentell profylakse (se også tabell 4.6 under). Aktuelle medikamenter forsøkes i lav dose, gjerne om kvelden:
- Ved hard avføring velg bløtgjørende, smørende eller volumøkende midler som laktulose, makrogol, ev. flytende parafin eller ispaghula. Rikelig væskeinntak er nødvendig for optimal virkning.
- Ved bløt avføring velg tarmstimulerende midler som natriumpikosulfat, bisakodyl eller sennaglykosider. Disse kombineres som regel med bløtgjørende, smørende eller volumøkende midler.
- Dersom diaré oppstår, tas opphold i laksantiatilførselen i 1-2 dager. Start så på nytt, ev. med halv dose. Dersom pasienten har fått kombinasjon av ulike laksantia, kan det være aktuelt å seponere det tarmstimulerende middelet.
- Dersom kolikksmerter oppstår, økes mengden bløtgjørende middel relativt til dosen stimulerende middel (Larkin et al., 2008).
- Dersom fekal inkontinens oppstår, reduseres dosen bløtgjørende middel relativt til dosen stimulerende middel, og stimulerende middel kan ev. økes (Larkin et al., 2008).
Behandling
Behandling av manifest obstipasjon hos en kreftpasient kan være svært utfordrende. Der det er mulig, bør predisponerende eller forverrende faktorer for obstipasjonen behandles og/eller korrigeres (se tabell 4.6 og under forebygging). Behandlingen av manifest obstipasjon styres etter antatt årsaksmekanisme (Miles et al., 2006).
Tabell 4.6
Oversikt over laksantia
|
Medikamentell behandling av ikke-obstruktiv obstipasjon
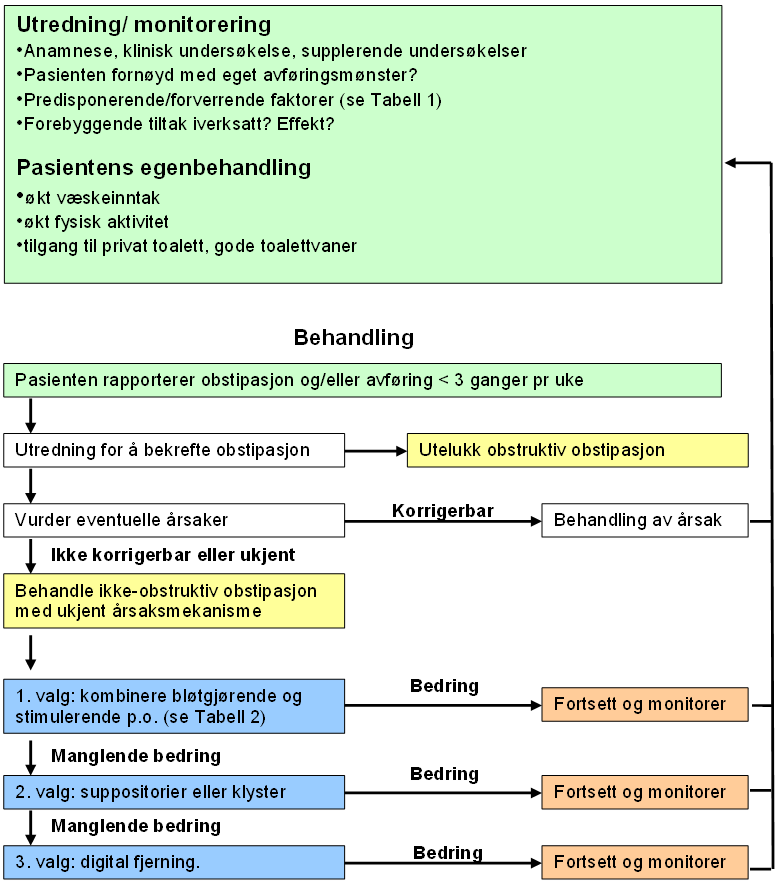
Tross grundig utredning og opprettholdelse av forebyggende tiltak, opplever mange pasienter i den palliative fasen behandlingskrevende obstipasjon der årsaksmekanismen forblir ukjent (se figur 4.3 nedenfor). I slike tilfeller er tiltaksrekkefølgen:
- Kombinasjon av bløtgjørende og stimulerende middel (evidensnivå C) (Larkin et al., 2008). Begynn med lav dose, gjerne om kvelden. Større doser deles. Aktuelle midler forsøkes i økende doser, titrering på individuell basis (evidensnivå C) (Droney et al., 2008; Larkin et al., 2008). Dersom fekal lekkasje oppstår, reduseres bløtgjørende, mens stimulerende ev. økes. Dersom kolikk-smerter oppstår, økes bløtgjørende relativt til stimulerende (evidensnivå C) (Larkin et al., 2008). Gjentatte systematiske oversikter har ikke kunnet påvise at en bestemt type eller kombinasjon av laksantia er bedre enn andre (evidensnivå C) (Miles et al., 2006).
- Retrograd tømning via suppositorier eller klyster
- Digital fjerning.
Hos de fleste palliative pasienter er det en rekke faktorer som disponerer for obstipasjon, inkludert bruk av opioider. Dette er viktig å huske på når en skal velge behandling. Det er dessuten interindividuell variasjon i forekomst av obstipasjon blant pasienter som får opioider (Droney et al., 2008). Noen opplever ikke obstipasjon selv om de ikke får laksantia. Noen opplever ikke obstipasjon fordi de får adekvat laksantiaprofylakse, mens noen forblir obstiperte til tross for høye doser og kombinasjon av ulike laksantia. Det er gjort en gjennomgang av effekt av ulike strategier ved obstipasjon blant langtkomne kreftpasienter som får opioider (Ahmedzai & Boland, 2010; Woolery et al., 2008):
- Redusere opioid-dose (evidensnivå C) (f.eks ved å legge til ikke-opioide ko-analgetika, nerveblokkade, behandle smerten med radioterapi/kjemoterapi/kirurgi). Anbefalt av EAPC (Caraceni et al., 2012).
- Bytte opioid: Sammenlignet med vannløselige opioider som morfin og oksykodon, gir mer fettløselige opioider som fentanyl og buprenorfin mindre obstipasjon ved samme grad av analgetisk effekt (evidensnivå A) (A. J. Clark et al., 2004; Radbruch et al., 2000). Å bytte til metadon gir lavere forbruk av laksantia (evidensnivå B) (Tamayo & Diaz-Zuluaga, 2004), men er en spesialistoppgave.
- Bytte administrasjonsvei for det aktuelle opioidet (evidensnivå B), for eksempel ved å redusere dosen, bytte opioid eller bytte administrasjonsvei for opioidet (Caraceni et al., 2012).
- Effekt av perorale laksantia:
- Laktulose og makrogol er like effektive i å redusere antall harde avføringer, og det er ingen forskjell i bivirkninger (evidensnivå A) (Freedman et al., 1997).
- Laktulose og sennaglykosider er like effektive i å redusere antall dager uten defekasjon, og det er ingen forskjell i bivirkninger (evidensnivå B) (Agra et al., 1998).
- Natriumpikosulfat er mer effektivt enn laktulose (evidensnivå B) (Wirz et al., 2012).
- Effekt av rektale laksantia:
- Natriumfosfat: Kan være assosiert med elektrolyttforstyrrelser og bør unngås blant eldre i palliativ behandling (evidensnivå B) (Mendoza, Legido, Rubio, & Gisbert, 2007).
- Effekt av opioidantagonister:
- Metylnaltrekson (evidensnivå A): Indisert ved opioidindusert obstipasjon når respons på vanlige laksantia ikke har vært tilstrekkelig. Sammenlignet med placebo gir preparatet økt frekvens av defekasjon innen 4-24 timer, redusert forbruk av andre laksantia og bedring i subjektiv opplevelse av obstipasjon (Candy, Jones, Goodman, Drake, & Tookman, 2011). Perifert virkende opioidantagonister har den fordel at de ikke passerer blod-hjernebarrieren, og kan derfor gis parenteralt uten tap av analgesi. Kontraindisert ved mekanisk obstruksjon og annen intraabdominal patologi. Doseres etter vekt, se felleskatalogen.
- Nalokson (evidensnivå B): I studier vist at dose på inntil 5 mg/døgn po kun i ubetydelig grad blokkerer sentrale reseptorer, mens perifere reseptorer blokkeres i høy grad. Vanlig dosering er Nalokson injeksjonsvæske pr os (blandet med vann) i startdose 0,4 mg x 4 første dag, 0,8 mg x 4 andre dag. Seponeres hvis ingen effekt etter to døgn. Kontraindisert ved mekanisk obstruksjon pga. fare for tarmperforasjon.
- Nalokson kombinert med oksykodon (evidensnivå A): Sammenlignet med placebo gir preparatet økt frekvens av defekasjon innen 2-6 uker (Meissner et al., 2009). Sammenlignet med oksykodon alene gir preparatet bedret tarmfunksjon, færre obstipasjonssymptomer, økt antall spontane tarmtømninger og redusert behov for tradisjonelle laksantia (Lowenstein et al., 2009). Nalokson blokkerer opioidreseptorene både sentralt og perifert. Peroral administrasjon gir bare 1 % systemisk biotilgjengelighet på grunn av nedbrytning i lever, og dermed blokkeres ikke den analgetiske virkningen av opioidet. Kan brukes i stedet for oksykodon opp til 80 mg, eller som tillegg ved høyere doser. Kontraindisert ved moderat til alvorlig nedsatt leverfunksjon. Bør heller ikke brukes hos pasienter med peritoneal carcinomatose eller stenoserende svulster i mage-tarmkanalen og bekkenet. Dosen økes over noen dager grunnet fare for økende buksmerter i starten.
- Naloxegol (evidensnivå A) har i flere studier med dosering 25 mg én gang daglig i opptil 4 uker, sammenliknet med placebo, vist bedret tarmtømming uten plagsomme bivirkninger, og er godkjent med refusjon til behandling av opioidindusert forstoppelse hos voksne som har hatt inadekvat respons på laxantia.
Basert på ovennevnte er tiltaksrekkefølgen for opioidindusert obstipasjon som følger:
- Kombinasjon av bløtgjørende og stimulerende middel (Caraceni et al., 2012). Laksantiadosen relativt til opioid-dosen (laksantia-dose/opioid-dose, ratio (LOR)) er lavere blant menn og yngre pasienter, samt hvis pasienten behandles med metadon eller har kreft som involverer abdomen (I. L. Mancini, Hanson, Neumann, & Bruera, 2000).
- Bruk av suppositorier eller klyster
- Digital fjerning
- Forsøke opioidantagonist som metylnaltrekson eller nalexogol, ev. kombinasjonpreparat med oxycodon og naloxon (ESMO guidelines 2018 (Larkin et al., 2018))
Til tross for kombinasjonsbehandling vil manifest, refraktær obstipasjon likevel ofte kreve hospitalisering og intensiv tarmtømming over flere dager. Slike belastende tømningsregimer tolereres ofte dårlig. Etter en gjennomgang av relevante studier, har man konkludert med at en innen palliasjon kan ha nytte av å følge gastroenterologiske retningslinjer for en supplerende utredning (K. Clark & Currow, 2012) for å skille mellom a) forstyrret nevro-muskulær funksjon i colon og b) forstyrret nevro-muskulær funksjon i defekasjons-strukturer. Utredningen kan inkludere blant annet måling av oroanal transitt-tid, anorektal manometri eller ballong ekspulsjons-test. Effekten av denne utvidede algoritmen er foreløpig ikke vitenskapelig dokumentert. Dersom slik ekstra utredning ikke fører fram, kan følgende konservative tiltak forsøkes, samtidig som den forebyggende behandlingen fortsettes (evidensnivå C):
- Retrograd tømning med gjentatte miniklyster med glyserol eller miniklyster/stikkpiller med bisakodyl. Fullstendig rektal lavage med temperert, isotont saltvann i doser på 1–2 liter kan ev. vurderes.
- Antegrad tømning med perorale tarmtømningsmidler som natriumfosfatsalter eller makrogol
- Makrogol kan være et godt alternativ for pasienter som klarer å drikke større væskemengder (4–8 poser makrogol løses i ½–1 l vann)
- Digital fjerning av impaktert fæces i rektumampullen, ev. i narkose eller diazepam-sedasjon, etter forutgående bløtgjøring med glyserol
- Erfaringsmessig finnes det enkelte tilfeller av ikke-obstruktiv obstipasjon der alle konservative tiltak viser seg utilstrekkelige. Invasiv intervensjon må da vurderes. En avlastende ileostomi kan i slike tilfeller også gi gevinst i form av at stadige sykehusinnleggelser med gjentatte, ofte svært belastende tømninger kan unngås.
Medikamentell behandling av obstruktiv obstipasjon
Oversikten over de ulike årsakene til obstruktiv obstipasjon viser at denne tilstanden sjelden oppstår akutt. Dermed følger også at klassisk strangulasjon av tarm er sjelden, og at akutt kirurgi derfor sjelden er indisert. Ved mekanisk obstruksjon skal man alltid først overveie invasiv intervensjon (se kapittel Malign obstruksjon i mage-tarmkanalen), før andre tiltak vurderes.
Aktuelle invasive tiltak:
- Endoskopisk dilatasjon, debulking eller stenting
- Palliativ reseksjon
- Bypass-operasjon (enterogastro-, entero-entero- eller enterocolon anastomose)
- Anleggelse av gastro-, entero- eller colostomi. Anleggelse av en enkel, toløpet bøyle-ileostomi er som regel et lite belastende inngrep, som av og til kan utføres i lokalanestesi.
I den aktuelle pasientpopulasjonen er det viktig å finne riktig balanse mellom potensiell risiko og gevinst. Følgende overveielser bør gjøres når man skal velge mellom invasiv eller non-invasiv (medikamentell) behandling:
- Pasientens ønsker
- Prognose, inkludert forventet levetid (hvis måned(-er), taler det for invasiv)
- Klinisk tilstand (alder, komorbiditet, ernæringsstatus, stadium av sykdom)
- Funn ved kartlegging av obstruksjonen (antall, nivå, årsak)
- Aktuelle invasive tiltak (gjennomførbarhet, effekt, risiko, gevinst)
Beslutningen om å utsette en sterkt redusert kreftpasient for et kirurgisk inngrep, må alltid treffes på grunnlag av en grundig analyse av pasientens totale situasjon, og aldri utelukkende på grunnlag av objektive funn.
Dersom invasive tiltak ikke er aktuelt, eller det dreier seg om partiell obstruksjon som foreløpig ikke er aktuell for invasive tiltak, kan konservativ, medikamentell behandling gi god symptomlindring. Initialt forsøkes behandling etter de prinsipper som er beskrevet under ikke-obstruktiv obstipasjon. Dersom nødvendig, forsøkes medikamentell behandling av tarmobstruksjon/ileus, se Malign obstruksjon i mage-tarmkanalen.
Alternative, ikke-medikamentelle metoder
Misrakasneham er brukt i tradisjonell indisk medisin. Middelet inneholder olje, melk og 21 ulike urter. Det synes å være like effektivt, og med samme grad av bivirkning, som senna (evidensnivå C) (Ramesh, Kumar, Rajagopal, Balachandran, & Warrier, 1998). En systematisk gjennomgang av litteraturen fant ingen påviselig effekt av massasje eller aromaterapi (evidensnivå B) (Shin et al., 2016).
Ved opioidindusert obstipasjon kan opioidantagonister prøves i tillegg ved manglende effekt av de beskrevne behandlingstiltak (se ESMO guidelines 2018 (Larkin et al., 2018)).