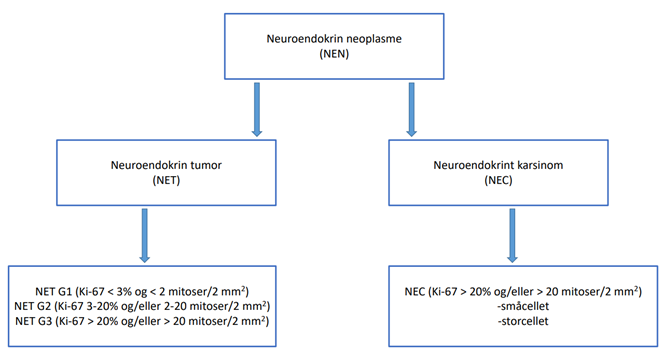
Gastroenteropankreatiske neuroendokrine neoplasmer klassifiseres i henhold til den gjeldende WHO-klassifikasjonen fra 2019 og er skjematisk fremstilt i figur 5.1 (WHO Classification of Tumours Editorial Board, 2019). I henhold til WHO-klassifikasjonen deles NEN inn i neuroendokrine svulster grad 1, 2 og 3 (NET G1, G2 og G3) og neuroendokrine karsinomer (NEC). NET er høyt differensierte NEN, og NEC er lavt differensierte NEN. GEP-NEN kan stadieinndeles i henhold til gjeldende UICCs TNM-klassifikasjon (Amin et al., 2017; Brierley et al., 2016) og ESMO-guidelines (Pavel et al., 2020) (basert på ENETS TNM-klassifikasjon). Med tanke på kvalitet i fremtidig forskning og registrering, er det anbefalt å bruke TNM-stadieinndeling også for NET/NEC pasienter (WHO Classification of Tumours Editorial Board, 2019).
Nevroendokrine svulster (NET) G1-G3
Ved NET er tumor bygget opp av ensartede celler med morfologi som likner normale neuroendokrine celler i gastrointestinaltrakten. Tumorcellene danner gjerne organoide reder og trabekler.
Morfologi kan variere noe etter hvilket organ tumor utgår fra. NET deles inn i tre grader ut fra proliferativ indeks vurdert ved hjelp av Ki-67 og/eller antall mitoser (NET G1-G3), se figur 5.1.
Noen pankreas NET kan etter behandling med alkylerende kjemoterapi (temozolomide) endre seg molekylært til høy tumormutasjonsbyrde (TMB) og endret Mismatch-reparasjonsstatus (MMR). Disse pasienter kan da ha nytte av immunterapi (de Mestier et al., 2025). Re-biopsi og ny NGS testing kan derfor vurderes ved progresjon hos pasienter som har mottatt alkylerende kjemoterapi.
Høyt differensierte NEN med Ki-67 > 20 % og/eller > 20 mitoser per 2 mm2 klassifiseres som NET G3 (Nagtegaal et al., 2020). De fleste NET G3 har Ki-67 20- 55%, median 30%. Dersom det foreligger en NET G3 med Ki-67 > 55% bør det vurderes om det likevel kan være en NEC. Dette fordi det er få (16 %) NET G3 som har Ki-67> 55% og fordi det har behandlingsmessig konsekvens.
Noen NET kan etter f.eks. behandling med DNA-ødeleggende medikamenter eller PRRT utvikle NEC-liknende morfologi (udifferensiert vekstmønster, nekroser, økt Ki-67 og tilkommet endringer i p53 og Rb uttrykk). Slike svulster omtales som NET G3 med NEC-liknende trekk (Joseph et al., 2024).
Neuroendokrint karsinom (NEC)
NEC er bygget opp av små, mellomstore eller store celler med udifferensiert vekstmønster, eller med vekstmønster som kan minne om NET (WHO Classification of Tumours Editorial Board, 2019). I tillegg har de en proliferativ indeks på > 20% og/eller > 20 mitoser. I de fleste tilfeller er Ki-67 betydelig høyere (vanligvis > 70-80%). Ved diagnose av NEC med Ki-67 < 55% bør en vurdere om det kan foreligge NET G3. Morfologisk sett deles NEC inn i småcellet og storcellet morfologi. Småcellet NEC likner morfologisk på småcellet karsinom i lunge, og kan ha negativ immunreaksjon for CgA. Disse svulstene har som oftest positiv reaksjon for synaptofysin.. Storcellet NEC er gjerne bygget opp av celler med store og pleomorfe kjerner som danner øyer/flak med eller uten nekroser, men kjertler kan også forekomme. I tilfeller hvor det foreligger lite differensierte GEP karsinomer bør patologene vurdere immunhistokjemiske (IHC) undersøkelser med neuroendokrine markører (synaptofysin, CgA og INSM1) for å se etter neuroendokrin differensiering i tumor. NEC viser gjerne sterk positiv reaksjon for synaptofysin og svak positiv eller negativ reaksjon for CgA.
Mixed neuroendokrin/non-neuroendokrine neoplasms (MiNEN)
MiNEN består av to ulike tumor-komponenter, en neuroendokrin komponent og ikke-neuroendokrin komponent. Som oftest er den ikke-neuroendokrine komponenten et adenokarsinom og den neuroendokrine komponenten et NEC, men også NET kan forekomme. Hvilke tumorkomponenter som er til stede, kan variere fra hvilken del av GI trakten tumor utgår. Hver tumorkomponent utgjør 30–70 % av tumor. Grensen på 30% er svært omdiskutert, og mange mener at det er nok med to klart separate svulsttyper for å kunne kalle det MiNEN. Dersom det foreligger en annen komponent i tumor, selv om det er i < 30% av tumor, bør dette angis og kvantifiseres, da dette påvirker prognose og har behandlingsmessige konsekvenser. På grunn av tumor heterogenitet kan blandet morfologi overses på små biopsier.
Proliferasjonsindeks Ki-67
Vurdering av proliferasjonsindeks ved hjelp av Ki-67 er obligatorisk for vurdering av tumorgrad (McCall et al., 2013; WHO Classification of Tumours Editorial Board, 2019). Ki-67 indeks skal vurderes i områder med flest positive kjerner, såkalte «hot-spots». Antall positive celler vurdert i et område med 500–2000 celler angis i prosent. Det er flere måter å regne ut proliferasjonsindeksen på (Reid et al., 2015).
Proliferasjonsindeksen skal angis med et mest mulig nøyaktig tallestimat (Rindi et al., 2006; Strosberg et al., 2010). Dette kan gjøres digitalt, ved hjelp av gitter, eller ved at en printer ut et Ki-67 farget snitt fra et «hot-spot»-område og teller på papiret (Reid et al., 2015). Bruk av digital bildeanalyse med kunstig intelligens vil kunne automatisere vurderingen av Ki-67, samt gi en objektiv og standardisert vurdering av proliferasjonsindeksen (Luchini et al., 2022). Ki-67 viser flere celler i deling sammenliknet med proliferasjonsindeks målt ved mitosetelling per 2 mm2, og det er dessuten vanskelig å identifisere «hot-spots» i tumor uten Ki-67. I de tilfeller der Ki-67 indeks og antall mitoser per 2 mm2 angir ulik grad, skal høyeste grad velges.
Molekylærpatologi ved nevroendokrine neoplasmer
Selv om NET og NEC kan ha overlappende morfologi, tyder genanalyser på at disse svulstene ikke er relaterte (Jiao et al., 2011; WHO Classification of Tumours Editorial Board, 2019). Ved NET i pankreas er det ofte mutasjoner i MEN1-genet, death-domain-associated protein- (DAXX) og alpha-thalassemia/mental reatardation syndrome X-linked- (ATRX) genene, gener assosiert med mTOR signalveiene, og noe sjeldnere von Hippel Lindau-relaterte gener (Jiao et al., 2011; WHO Classification of Tumours Editorial Board, 2019). Disse mutasjonene er vanligvis ikke til stede ved NEC i pancreas. I disse svulstene er det vanligere med mutasjoner eller genetiske endringer i TP53, RB1 og andre karsinomassosierte gener (Jesinghaus et al., 2017; Konukiewitz et al., 2017; Yachida et al., 2012). Sporadiske NET i pankreas kan også være assosiert med mutasjoner i DNA reperasjonsgenene MUTYH, CHEK2 og BRCA2 (Waddell et al., 2015; WHO Classification of Tumours Editorial Board, 2019). I tilfeller der det er vanskelig å skille mellom NET G3 og NEC, kan supplerende immunhistokjemiske undersøkelser med antistoff mot DAXX, ATRX, p53 og Rb være til hjelp. Primære pankres NET G3 kan ha tap av DAXX og ATRX, men som oftest normalt uttrykk av Rb1 og p53. PanNEC har som oftest bevart ekspresjon for DAXX og ATRX, men aberrant ekspresjon for p53 og tapt ekspresjon for Rb1 (Nagtegaal et al., 2020; Pavel et al., 2020). BRAF mutasjon påvises hyppig ved NEC i kolon og MSI påvises hos 3-4% av GI-NEC (Venizelos et al., 2021).
De fleste GEP-NEN har lav tumor mutasjonsbyrde (TMB) og er mikrosatellittstabile (MSS), noe som kan tyde på begrenset effekt av immunsjekkpunkthemmere. Noen få svulster kan imidlertid ha høy TMB, og undersøkelser mtp MSI-status og eventuelt TMB kan i noen tilfeller vurderes. NET G3 blir ofte mer aggressiv over tid, og i sjeldne tilfeller kan de utvikle en genetisk profil som ligner NEC («NET med NEC liknede trekk ”). I NET G3 med NEC-lignende morfologi er det observert nye mutasjoner i TP53 (100%) og RB1 (12%) i tillegg til bevarte NET-typiske mutasjoner som DAXX og MEN1 (Kasajima et al., 2024). I forbindelse med DNA-ødeleggende behandling (som f.eks. PRRT og TMZ) kan det oppstå p53 mutasjoner og i noen tilfeller tap av RB1, noe som kan føre til dedifferensiering av tumor og NEC-likende morfologi (Cordero-Hernandez et al., 2024; Joseph et al., 2024; Kasajima et al., 2024; Sorbye et al., 2023).
Anbefalinger
- Ved mistanke om NEN bør som et minimum følgende angis i et patologisvar:
- Differenseringsgrad (høyt eller lavt differensiert)
- Immunhistokjemi med kromogranin A og synaptofysin
- Immunhistokjemi med Ki-67 for vurdering av proliferasjonsindeks i «hotspots» med mest mulig nøyaktig tallangivelse
- Ved NEC: småcellet eller storcellet morfologi
- Bruk av gjeldende WHO-klassifikasjon