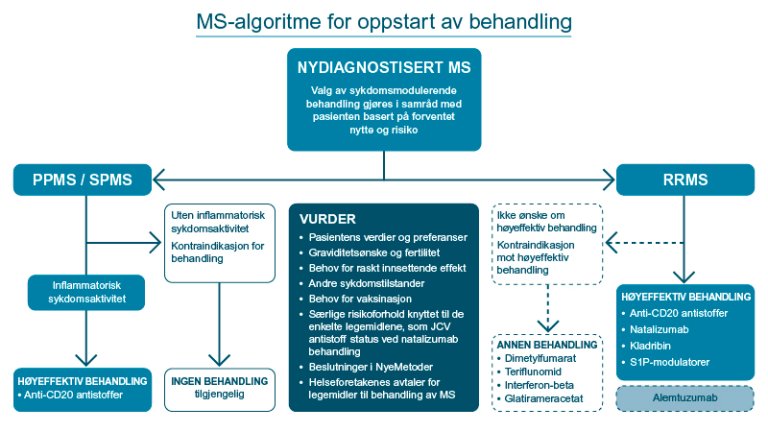
Forskningsgrunnlag for start med høyeffektiv sykdomsmodulerende behandling
Først omtales kort de inkluderte studiene, deretter kommer oppsummering av resultatene for problemstillingen. "Hva er effekt av start med høyeffektiv behandling sammenlignet med annen behandling (moderat eller laveffektiv behandling) for personer med MS på funksjon (EDSS), bivirkninger, konversjon til progressiv MS og behov for legemiddelbytte?"
Hillert 2021
Forfatterne har gått sammen om å lage et nettverk med MS data (Big MS Data Network, BMSD) med data fra fem ulike registre, Danish MS Registry, Italian MS Registry, the Observatoire Français de la Sclérose en Plaques (OFSEP) registry, the MSBase Study Group og the Swedish MS Registry (Hillert et al., 2021).
I publikasjonen er det informasjon fra om lag 110 000 pasienter i perioden 1997 til 2016. Forfatterne har sett på behandlingsstopp; alle årsaker, midlertidige opphold, bytte til andre legemidler og varig seponering. Doseendring eller å legge til et ekstra legemiddel ble ikke regnet som opphold i behandling.
Brown og medarbeidere 2019
Forfatterne har undersøkt om det er en sammenheng mellom type legemiddel og timing av legemiddelstart og risiko for konversjon til sekundær progressiv MS. Det ble inkludert data fra registre i 21 land (MSBase + fem andre) (Brown et al., 2019). Deltakerne startet med legemiddelbehandling eller klinisk oppfølging i perioden 1988 til 2012, og det var krav om minst fire års oppfølgingstid. Legemidler som ble undersøkt var: interferon beta, glatirameracetat, fingolimod, natalizumab og alemtuzumab. Totalt 1555 pasienter ble matchet og inngikk i analysene.
Buron og medarbeidere 2020
Forfatterne undersøkte effekten av å starte med høyeffektive legemidler, definert som natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab, sammenliknet annen behandling, definert som interferon beta, teriflunomid, dimetylfumarat eller glatirameracetat, på funksjonsforverring (EDSS) og attakkrate (Buron et al., 2020). De inkluderte behandlingsnaive pasienter fra det danske MS registeret og matchet 194 personer i hver gruppe. Personene hadde startet legemiddelbehandling i perioden 2001 til 2018. Primærutfallet var tid til 6 måneders bekreftet forverring i EDSS. Sekundærutfall var tid til første attakk.
He og medarbeidere 2020
He og medarbeidere sammenliknet funksjonsendring (EDSS) på lang sikt mellom pasienter som startet med høyeffektive legemidler i løpet av det første to årene fra diagnose med pasienter som først startet etter fire til seks år (He et al., 2020). I begge grupper kunne deltakerne ha fått annen sykdomsmodifiserende behandling før de fikk høyeffektive legemidler. De har benyttet MSBase registeret og det svenske MS-registeret som kilde. De har kategorisert rituksimab, okrelizumab, mitoksantron, alemtuzumab og natalizumab som høyeffektive legemidler.
He og medarbeidere hentet ut data til sine analyser fra registre i april 2017 for MSBase og september 2019 fra MS-registeret i Sverige. Inklusjonskriteret var minst seks sammenhengende måneder med høyeffektive legemidler og oppfølging i minst seks år fra sykdomsdebut. Totalt ble 213 personer som startet behandling innen to år matched med 253 personer som startet innen fire til seks år.
Iaffaldano og medarbeidere 2021
Iaffaldano og medarbeidere undersøkte tidlig start med høyeffektive legemidler, definert som fingolimod, natalizumab, mitoksantron, kladribin, med en eskaleringsstrategi hvor pasientene startet med glatirameracetat, interferoner, azathioprine (median tid til eskalering var 6,3 år) (Iaffaldano et al., 2021). Utfallene var endring i EDSS score opp til ti års oppfølgingstid. Forfatterne fikk matchet 363 par, fra 62 italienske MS sentra.
Sacca og medarbeidere 2019
Sacca og medarbeidere hadde som målsetting å identifisere prognostiske faktorer for behov for tidlig legemiddelbytte. De inkluderte 2954 nylig diagnostiserte pasienter fra 24 italienske MS sentra (iMUST) (Sacca et al., 2019). Årsaken til legemiddelbytte ble kategorisert som grunnet enten mangelfull effekt eller knyttet til manglende toleranse og sikkerhet.
Hanninen og medarbeidere 2021
Hanninen og medarbeidere undersøkte 6 måneders bekreftet EDSS progresjon og tid til første attakk hos finske pasienter med RRMS som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab (154 pasienter) sammenliknet med pasienter som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (1771 pasienter) (Hanninen et al., 2021). Inkluderte pasienter måtte ha startet med behandling innen tre år etter diagnose og ha minst 2,5 års oppfølgingstid. Det er gjort analyser for gruppene som helhet og for matchede pasienter.
Harding og medarbeidere 2019
Harding og medarbeidere benyttet data fra sørøst Wales (Harding et al., 2019). De undersøkte endring i EDSS score etter 5 år og bekreftet funksjonsforverring hos personer behandlet med alemtuzumab eller natalizumab sammenliknet med personer behandlet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid. Totalt startet 104 personer i den første gruppen og 488 i den andre gruppen. Personene som startet rett på høyeffektiv behandling var på gruppenivå noe yngre og hadde hatt flere årlige attakker(ARR) enn de som startet med en eskaleringsstrategi.
Simonsen og medarbeidere 2021
Simonsen og medarbeidere benyttet databasen BOT-MS (Buskerud, Oslo og Telemark) og inkluderte alle pasienter som hadde blitt behandlet med høyeffektive legemidler, definert som natalizumab, fingolimod eller alemtuzumab, eller med annen behandling, definert som interferon beta, glatirameracetat, teriflunomid eller dimetylfumarat, for mer enn 12 måneder (N=694) (Simonsen et al., 2021). Hovedutfallet var andel uten ny sykdomsaktivitet men det er også informasjon om legemiddelbytter.
Resultater
Funksjonsendring (EDSS)
He og medarbeidere utførte analyser på forskjell i EDSS score i perioden seks til ti år etter sykdomsdebut mellom matchede pasienter som startet med høyeffektiv behandling (rituksimab, okrelizumab, mitoksantron, alemtuzumab eller natalizumab) tidlig (innen 0-2 år) sammenliknet med senere (4-6 år) (He et al., 2020). Det var mulig med annen sykdomsmodifiserende behandling før start med høyeffektive legemidler og 73 % av de i sen oppstart gruppen hadde fått interferon beta eller glatirameracetat som første behandling.
Justert forskjell i gjennomsnitt EDSS score for hele perioden seks til ti år etter sykdomsdebut var -0,98 poeng (95 % KI fra -1,51 til – 0,45) i favør av tidlig start. Andel pasienter med EDSS score over seks var også konsistent høyere for de med sen oppstart sammenliknet med tidlig oppstart Måletidspunkt var seks til ti år etter sykdomsdebut.
Harding og medarbeidere analyserte 41 pasienter som startet med alemtuzumab eller natalizumab sammenliknet med 138 personer behandlet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (Harding et al., 2019). De måtte ha tilgang til EDSS score ved baseline og etter 5 års oppfølgingstid for å bli analysert. En regresjonsmodell med justering for kovariater/forklaringsvariabler viste at gruppen som startet med høyeffektiv behandling hadde en lavere endring i EDSS score enn de som startet i eskaleringsgruppen, β = −0,85; 95% KI, −1,38 til −0,32. En sensitivitetsanalyse hvor fingolimod ble flyttet til høyeffektivgruppen endret ikke resultatene.
Iaffaldano og medarbeidere matchet 363 pasienter som startet enten fingolimod, natalizumab, mitoksantron eller kladribin med 363 pasienter som startet med glatirameracetat, interferon beta eller azathioprine (Iaffaldano et al., 2021). Det ble rapportert på forskjell mellom gruppene i endring av EDSS score fra baseline til måletidspunktet. Det var statistisk signifikant lavere endring i EDSS score for gruppen som startet med høyeffektiv behandling sammenliknet med de som inngikk i en eskaleringsstrategi ved alle årene 1 til 10 etter oppstart.
Risiko for funksjonstap
He og medarbeidere 2020 sine analyser av data fra MSBase og det svenske MS registeret viste at kumulativ risiko for sykdomsforverring var lavere i gruppen med tidligere start av høyeffektive legemidler (HR 0,34, 95 % KI 0,23–0,51) (He et al., 2020). Analysen går fra første gang pasienten fikk et sykdomsmodifiserende legemiddel. Forskjellen gjelder også for analyser fra sykdomsstart HR 0,46, 95 % KI 0,31–0,68. Høyeffektiv behandling besto av rituksimab, okrelizumab, mitoksantron, alemtuzumab og natalizumab. Tidlig start var 0-2 år etter sykdomsdebut, mens forsinket start var innen 4-6 år. I begge grupper kunne de ha fått annen sykdomsmodifiserende behandling først.
Buron og medarbeidere 2020 benyttet det danske MS registeret og fant at gruppen som fikk natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab hadde lavere risiko for vedvarende EDSS forverring enn de som fikk interferon beta, teriflunomid, dimetylfumarat eller glatirameracetat, HR 0,53, 95 % KI 0,33–0,83 (Buron et al., 2020).
Hanninen og medarbeidere 2021 benyttet det finske MS registeret og fikk matchet 66 pasienter som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab med 66 pasienter som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (Hanninen et al., 2021). Pasientene hadde inntil seks års oppfølgingstid. Sannsynligheten for 6 måneders sykdomsforverring målt ved EDSS var lavere ved både 3 og 5 år for de som fikk de høyeffektive legemidlene. Totalt sett var HR 0,60, 95 % KI 0,39–0,91. En sensitivitetsanalyse hvor fingolimod ble inkludert i høyeffektiv gruppen gjorde at funnene ikke lenger var signifikant n=73; HR 0,74 95 % KI 0,49–1,11.
Harding og medarbeidere rapporterte at median tid til vedvarende sykdomsprogresjon (i EDSS) var 6 år (95% KI, 3,4-8,2) for de som startet med alemtuzumab eller natalizumab og 3.1 (95% KI, 2,6-4,0) for personer i eskaleringsgruppen som startet med interferon beta, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (log-rank test P =0,05) (Harding et al., 2019). Det ble ikke vist statistisk signifikant forskjell i tid til vedvarende sykdomsprogresjon, justert hazard ratio, 0,74; 95 % KI, 0,52-1,06.
Konversjon til sekundær progressiv MS
Brown og medarbeidere viste at pasienter som startet med fingolimod, alemtuzumab eller natalizumab (n = 235) hadde lavere konversjon til sekundær progressiv MS enn matchede pasienter som startet med glatirameracetat eller interferon beta (n = 380), HR var 0,66 (95 % KI, 0,44-0,99; median oppfølgingstid 5,8 år; IQR, 4,7-8,0 år) (Brown et al., 2019). Etter 5 år hadde, 7 % vs 12 %, og etter 9 år hadde 16 % vs 27 %, konvertert til sekundær progressiv MS.
Attakkrate
Hanninen og medarbeidere rapporterte at sannsynligheten for attakk ved 3 og 5 år var 27,6% (95 % KI 18,5–35,7) og 34,6 % (95 % KI 24,1–43,6) i gruppen som fikk natalizumab, alemtuzumab, okrelizumab eller rituksimab og 43,9 % (95 % KI 33,5–52,6) og 47,2% (95 % KI 36,6–56,1) hos de som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid (Hanninen et al., 2021). Gjennomsnittlig antall attakker i oppfølgingsperioden på max 6 år var 0,7 (sd 1,54) i høyeffektiv gruppen og 1,4 (sd 2,5) hos de som fikk annen behandling.
Tid til nytt attakk
Buron og medarbeidere rapporterte at personer som fikk natalizumab, fingolimod, alemtuzumab, kladribin, daclizumab eller okrelizumab hadde lengre tid til første attakk sammenliknet med de som fikk interferon-beta, teriflunomid, dimetylfumarat eller glatirameracetat, HR 0,50, 95 % KI 0,37–0,67 (Buron et al., 2020).
Hanninen og medarbeidere rapporterte at pasientene som startet med natalizumab, alemtuzumab, okrelizumab eller rituksimab hadde lavere rate til første tilbakefall/attakk enn de som startet med dimetylfumarat, glatirameracetat, interferon beta eller teriflunomid, HR 0,70, 95 % KI 0,52–0,94, basert på 2x105 matchede pasienter (Hanninen et al., 2021). En sensitivitetsanalyse hvor fingolimod ble inkludert viste tilsvarende resultat, n=115; HR 0,64 95 % KI 0,52–0,94.
Behov for å bytte legemiddel
Hillert og medarbeidere definerte bytte av legemiddel dersom det ikke var mer enn seks måneder mellom avslutting av et legemiddel og start med et annet. Forfatterne har analysert for IFNβ-1a IM, IFNβ-1a SC, IFNβ-1b, glatirameracetat, IFNβ-1a uspesifisert, natalizumab, rituksimab, fingolimod, dimetylfumarat, teriflunomid, alemtuzumab og andre (Hillert et al., 2021).
I løpet av observasjonsperioden 1997 til 2016 ble 68 % av legemiddelbehandlingene stanset. Av disse byttet 87 % til et annet legemiddel innen 6 måneder. Antall stans omregnet til insidens per personår med behandling:
- Fingolimod 19,7 stopp per 100 personår, 95 % konfidensintervall (19,2 til 20,1)
- Natalizumab 22,6 stopp per 100 personår,95 % konfidensintervall (22,2 til 23. 0)
- Interferon beta 23,3 stopp per 100 personår,95 % konfidensintervall (23,2 til 23,5))
- Glatimeracetat 25,8 stopp per 100 personår,95 % konfidensintervall (25,4 til 26,2)
- Teriflunomid, alemtuzumab, rituksimab – ikke rapportert
Sacca og medarbeidere brukte data fra italienske MS sentra og fant at risiko for å bytte legemiddel på grunn av mangelfull effekt var redusert med 50 % for fingolimod, 87 % for natalizumab, 40 % for dimetylfumarat og 79 % for teriflunomid sammenliknet med interferon beta. Interferon beta og glatirameracetat hadde tilsvarende risiko for bytte (Sacca et al., 2019). Alle forskjellene var statistisk signifikante. Sammenliknet med interferon beta var risiko for bytte av legemiddel på bakgrunn av toleranse/sikkerhet følgende glatirameracetat HR 0,61 (0,46–0,81), dimetylfumarat 0,57 (0,35–0,92), fingolimod 0,35 (0,19–0,68) og natalizumab 1,43 (1,05– 1,94).
Simonsen og medarbeidere rapporterte at pasienter som startet med interferoner, glatirameracetat, teriflunomid eller dimetylfumarat hadde større sannsynlighet for å måtte bytte legemiddel enn de som startet behandling med natalizumab, fingolimod eller alemtuzumab, 65,2 vs. 29,2 %, p < 0.001 (Simonsen et al., 2021).
Alvorlige bivirkninger
Hanninen og medarbeidere rapporterte ingen dødsfall i høyeffektiv gruppen (n=154) og syv dødsfall i gruppen som fikk annen behandling (n=1771), hvorav ett var omtalt som "advanced MS" (Hanninen et al., 2021).
Harding og medarbeidere rapporterte om utvikling av autoimmune tilstander hos 47 % av de som fikk alemtuzumab og totalt 7 alvorlige uønskede hendelser (1,4 %) hos de som var i eskaleringsgruppen som startet behandling med interferoner, glatirameracetat, dimetylfumarat, fingolimod, eller teriflunomid (Harding et al., 2019).
Bivirkningsrate
Hanninen og medarbeidere rapporterte at det ikke var signifikant forskjell i uønskede hendelser mellom de som fikk høyeffektive legemidler og de som fikk andre legemidler, med henholdsvis 8,4 % og 14,2 % (Hanninen et al., 2021).
Livskvalitet
Livskvalitet var ikke rapportert for denne problemstillingen i identifisert forskning.
Nye MR-lesjoner
Nye MR-lesjoner var ikke rapportert for denne problemstillingen i identifisert forskning.