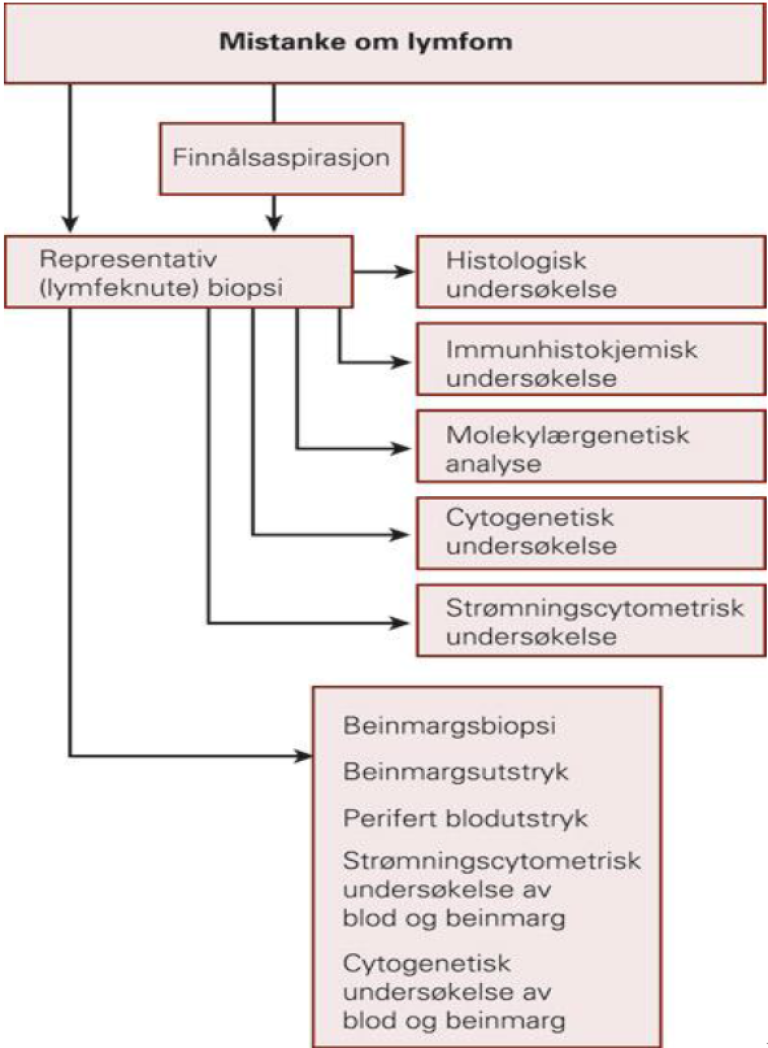
Det er utarbeidet detaljerte nasjonale retningslinjer for hematopatologisk diagnostikk (se Vedlegg 1). WHO-klassifikasjonen bruker multiple parametere for å klassifisere lymfomer. Ettersom lymfompatologi kan være krevende, må det diagnostiske biopsimaterialet der det er begrunnet mistanke om lymfom, sendes direkte til spesialavdeling for lymfomdiagnostikk. Disse kan utføre nødvendige tilleggsundersøkelser (immunhistokjemi, genotyping med tanke på klonalitet, in situ hybridisering med tanke på bestemte translokasjoner eller Epstein Barr virus). Patologen er ansvarlig for å bruke de undersøkelser som er nødvendig for å stille en sikker diagnose basert på WHO-klassifikasjonen. Bruk av tilleggsundersøkelser er avhengig av lymfomtype.
Histopatologisk utredning av malignt lymfom forutsetter representativ biopsi av affisert vev (helst lymfeknute der dette er tilgjengelig) og benmargsbiopsi og aspirat for immunhistologiske undersøkelser. Finnålsaspirasjonscytologi (FNAC) er kun unntaksvis indisert når det trengs et raskt foreløpig svar for behandling. FNAC skal alltid følges opp med en representativ biopsi for fullstendig typing av lymfomet. Der det ligger til rette for det anbefales kirurgisk biopsi fremfor nålebiopsi fordi det øker sjansen for representativt materiale og dermed for å oppnå korrekt diagnose. Flowcytometriske undersøkelser av blod og benmarg utfyller morfologisk undersøkelse av biopsi og aspirat, både med hensyn til hvorvidt sykdomsaffeksjon foreligger og eventuelt hvilken subtype. Visse typer lymfom er lettere å påvise med en teknikk fremfor en annen, avhengig av lymfomtype og graden av affeksjon. Flowcytometri er spesielt egnet ved småcellet lymfom i benmarg og blod. Hvilke undersøkelser som er indisert/nødvendig for de ulike diagnoser er varierer.
Biopsimateriale
WHO-klassifikasjonen bruker en multiparametrisk tilnærming til lymfomklassifikasjon. Dette innebærer at morfologisk undersøkelse, immunfenotypisk undersøkelse, molekylærgenetiske, cytogenetiske, enkelte ganger virologiske og kliniske data kombinert danner det diagnostiske grunnlaget for lymfomtypen, eller snarere, lymfomentiteten.
Eksempler på dette er:
- Klonalitetsundersøkelse enten ved immunfenotyping eller molekylærgenetisk undersøkelse er absolutt nødvendig for å diagnostisere posttransplantasjonslymfoproliferativ sykdom
- Påvisning av Epstein-Barr virus er nødvendig for å diagnostisere ekstranodalt NK/T-celle-lymfom nasal type
- Klinisk informasjon mhp mediastinal lokalisasjon er nødvendig for diagnosen mediastinalt (thymisk) storcellet B-celle lymfom
- Påvisning av HTLV-1 smitte er nødvendig for å å stille diagnosen adult T-celle leukemi/lymfom
I og med at man ikke vet hvilke parametre som til slutt vil danne del av diagnose-grunnlaget ved forsendelse av vev til patologen, må vevet sendes på en standardisert måte sammen med relevante kliniske opplysninger.
Husk at jo større biopsi, jo bedre og raskere kommer man frem til en diagnose. Små biopsier resulterer ofte i ufullstendig undersøkelse og gjør det ofte nødvendig å rebiopsere (med tilsvarende forsinkelse av diagnose og behandling). Nålebiopsier bør derfor unngås så sant det er mulig.
En biopsi bør være så representativ som mulig. Ikke ta ut vev for diagnose kun fordi det er enklere å fjerne enn mer utbredt vevsaffeksjon på et vanskeligere tilgjengelig sted. I stedet, ta den biopsien som mest sannsynlig inneholder den mistenkte tumor. Ved generell perifer glandelsvulst er lyske-biopsi minst egnet for histologisk diagnostikk fordi lymfeknutene her oftere har reaktive forandringer enn i andre lokalisasjoner. Bruk av PET / CT kan være nyttig spesielt ved mistanke om transformasjon: biopsien tas fra område med høyest opptak.
Relevant klinisk informasjon som det bør opplyses om til patologen
- Type vev
- Hensikten med undersøkelsen: diagnostisk prøve, oppfølging, mistanke om hematologisk sykdom
- Sykdommens lokalisasjon: lymfeknute, ekstranodal affeksjon, splenomegali, hepatomegali, leukemi Sykdomsdebut
- Kort sykehistorie: organtransplantasjon, hepatitt C virus infeksjon, HTLV-1 infeksjon, langvarig medikamentell behandling som f.eks. metotreksat, difenylhydantoin, immunsuppressiva
- Patologer bør alltid informeres om mulig smittefare: hepatitt virus, mykobakterier, HIV
Standard forsendelse av vev
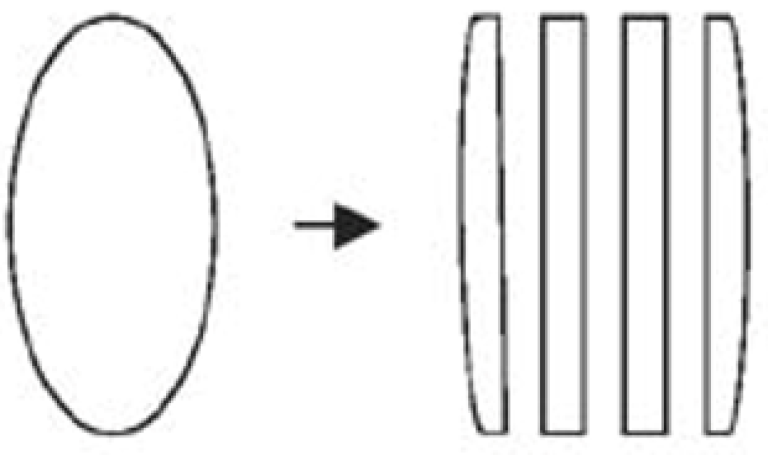
Generelt bør biopsi for lymfomdiagnostikk tas tidlig på dagen og helst ikke på fredager på grunn av håndtering av ferskt materiale. Alt vev, med unntak av benmargsbiopsier (se nedenfor), bør fortrinnsvis sendes ufiksert til patologen. Åpningstider for laboratoriet bør verifiseres på forhånd. Rutiner vedrørende forsendelse, transportmedium, transportbeholder m.v. bør avtales med laboratoriet som skal motta prøven. Vevsbiten må ikke bli liggende uten væske, da vil den fort tørke ut og tape kvalitet både i forhold til morfologi og tilleggsanalyser. Vevsbiten legges i avkjølt Ringers væske eller annet transportmedium i en mindre beholder. Dersom materialet ikke forventes å nå frem til patologilaboratoriet innen 30 minutter, bør beholderen med vevsbiten holdes avkjølt på isbiter i egnet beholder (f.eks. termosflaske). NB! Tørris må ikke brukes. Dersom biopsi-materialet ikke vil rekke frem innen 24 timer etter biopsitakningen, bør man fiksere minst en halvdel av materialet i formalin, mens den annen del sendes ufiksert og nedkjølt som beskrevet ovenfor. Ved tvil om det er nok vev til å ta av en bit ferskt vev eller om dette vil komme frem til laboratoriet i tide, legges alt vevsmateriale direkte i formalin. I så tilfelle, bør kirurgen dele opp vevet i tynne skiver (ikke tykkere enn 3 mm) på langs for å sikre god fiksering. Se figur 6. Ved oppdeling må man være forsiktig slik at vevet ikke blir klemt.
Benmargsbiopsi
I prinsippet tas benmargsbiopsier kun for stadieinndeling av lymfomer, ikke for å stille en nøyaktig diagnose. For dette formål må helst annen type vev sendes. Det er flere grunner til dette: noen lymfomer forandrer morfologi når de affiserer benmarg, f.eks. kan follikulært lymfom ha et utseende som ser mer lavgradig ut i benmargen enn i lymfeknuten; dekalsifisering av benmargen (som er nødvendig del av fremføringen) begrenser mulighetene for ulike undersøkelser som er mulig å gjøre på annet biopsimateriale; det er ofte minimal lymfomaffeksjon slik at fullstendig typing med immunhistokjemi kan vise seg umulig. Unntak fra denne regelen gjelder for diagnostisering av de lymfomproliferative sykdommene som er primære i benmarg, så som KLL, myelomatose og lymfoplasmacyttisk lymfom.
Relevant klinisk informasjon som det bør opplyses til patologen
Se avsnitt over om Biopsimateriale.
Standard forsendelse av vev
Benmargsbiopsien bør være stor nok, det vil si minimum 2 cm. I tillegg må man passe på ikke å klemme vevet ved biopsitaking. Biopsien bør sendes i egnet fikseringsmiddel. Laboratoriene bruker forskjellige fikseringsmidler, og man bør derfor ta kontakt med patologen som skal motta biopsien for informasjon vedrørende fikseringsprosedyre.
Blod og benmargsutstryk
Se ovenstående vedrørende benmargsbiopsi. Utstryk kan gi tilleggsinformasjon til benmargsbiopsien, særlig er den morfologiske vurderingen av småcellete lymfomer mer eksakt. F.eks. er diagnosti-sering av storgranulær T-lymfocyttleukemi svært vanskelig på benmargsbiopsien alene.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av utstryk
- Bruk fettfrie objektglass. Legg en liten dråpe blod/benmarg på den ene enden av glasset. Når det gjelder benmarg, må man forsikre seg om at benmargselementer er inkludert. Enkelte ganger kan det hjelpe å skylle ut sprøyten i EDTA før man aspirerer. Dette kan hindre at aspiratet klumper seg før utstryket lages.
- Dra glasset til å lage utstryket (slepet utstryksglass) mot dråpen i en vinkel på 30 grader til det berører blod/ benmargsdråpen. Blodet vil spre seg bak utstryksglasset ved hjelp av kapillarkraft, og man bør la det spre seg utover i glassets fulle bredde.
- Dra utstryksglasset lett og raskt nedover glasset slik at det dannes en fin hale.
- Lufttørk utstryket. Merk glasset med pasientens fulle navn (med blyant).
- Fiksering med metanol er å anbefale ved forsendelse
Flowcytometrisk undersøkelse
Flowcytometrisk undersøkelse har to store fordeler: multiparametrisk immunfenotyping gir en mer eksakt immunfenotype av cellene. Dette er viktig dersom man ønsker å påvise koekspresjon av markører på samme cellepopulasjon. Et typisk eksempel på dette er påvisning av restriksjon for immunglobulin lett kjede i B-celle neoplasier. Teknikken er også mer sensitiv når det gjelder å påvise små tumorpopulasjoner.
Det anbefales sterkt at den flowcytometrisk ansvarlige selv vurderer morfologien av tilsendt materiale før det analyseres, eventuelt har mulighet for å få en morfologisk vurdering. Grunnen til dette er at man kan arbeide mer målrettet med tanke på å bestemme antistoffpanelet som skal brukes flowcytometrisk. Dette vil i stor grad øke det utbyttet man kan få av undersøkelsen.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av prøvemateriale
- Ta kontakt med den flowcytometrisk ansvarlige for nærmere retningslinjer, da disse kan være forskjellig fra laboratorium til laboratorium. Retningslinjene nevnt nedenfor er derfor generelle.
- Generelt bør prøven inneholde minimum 5 ml blod eller benmarg, tilsatt konserveringsfritt heparin som antikoagulasjonsmiddel. Vær nøye med å blande aspirert materiale (særlig benmarg) og heparin slik at koagulering unngås. Hvis utstrykspreparatet vurderes et annet sted (kliniker eller patologilaboratorium), må man huske å sende ekstra lufttørket utstryk sammen med den flowcytometriske prøven.
- Prøvene må ankomme laboratoriet senest 24 timer etter prøvetaking.
- Der man ønsker å utføre flowcytometri av vev, må biopsien sendes ufiksert og nedkjølt.
- Dersom annet biologisk materiale (eks. pleuravæske) ønskes undersøkt med flowcytometri, se under finnålsaspirasjon.
Finnålsaspirasjon
Finnålsaspirat kan undersøkes raskt, i motsetning til biopsier. Utbyttet er imidlertid såpass redusert sammenlignet med biopser at riktig WHO-klassifisering av lymfomet vanligvis ikke er mulig.
Finnålsaspirasjon bør derfor være forbeholdt de tilfellene hvor det ønskes et foreløpig svar innen 24 timer, enten for rask behandlingsstart eller for en mer effektiv organisering av den diagnostiske utredningen av pasienten. Flowcytometrisk undersøkelse kan gi verdifull tilleggsinformasjon særlig for B-celle lymfomene. Finnålsaspirasjon bør alltid følges opp med biopsitaking. Finnålsaspirasjon vil som regel gi et negativt resultat ved Hodgkin lymfom, og uten flowcytometri, ofte ved visse lymfomer som follikulært lymfom og andre saktevoksende lymfomer.
Relevant klinisk informasjon
Se avsnitt over om Biopsimateriale.
Standard forsendelse av prøvemateriale
- Ta kontakt med cytologen/den flowcytometrisk ansvarlige for nærmere retningslinjer, da disse kan være forskjellig fra laboratorium til laboratorium. Retningslinjene nevnt nedenfor er derfor generelle. Utstryk fikseres før forsendelse.
- Dersom man i tillegg til de lufttørkete utstrykene skal sende materiale til flowcytometrisk undersøkelse, bør dette sendes i RPMI-væske (kfr. flowcytometrisk undersøkelse). Send alltid lufttørket utstryk sammen med prøven (se ovenstående).
- Prøvene må ankomme laboratoriet senest 48 timer etter prøvetaking, og helst innen 24 timer.
Cytogenetiske undersøkelser
Dette inngår ikke som rutineundersøkelse for de fleste tilfelle av maligne lymfomer, men bør utføres ved mistanke om lymfoblastlymfom. Mange typer av malignt lymfom karakteriseres ved spesifikke kromosomavvik, og påvisning av slike kan avklare en ellers vanskelig diagnose.
Dette er krevende og utføres foreløpig bare ved Avdeling for genetikk, Oslo Universitetssykehus, Radiumhospitalet (vev, blod og benmarg) og ved Avdeling for genetikk, Haukeland Universitetssykehus (blod og benmarg). En vellykket undersøkelse kan avklare om en neoplastisk prosess foreligger eller ikke, og kan, ved påvisning av spesifikke kromosomavvik være av stor betydning for diagnose og behandlingsvalg.
Spesifikke immunhistokjemiske og karyotypiske trekk for de viktigste lymfomtyper er angitt under kapitlet om behandling.
Enkelte av de forandringene som påvises ved de tradisjonelle cytogenetiske undersøkelsene kan også påvises ved molekylærgenetiske metoder (PCR, FISH f eks ved t(8;14) ved Burkitt lymfom). I tillegg til translokasjoner kan disse metodene også påvise monoklonalitet. Metodene utføres ved flere patologiske laboratorier.
Relevant klinisk informasjon
Rekvisisjon for kromosomundersøkelse kan fås ved henvendelse til Laboratorium for cytogenetikk Avdeling for Patologi, Oslo Universitetssykehus eller tilsvarende ved Haukeland Universitetssykehus HF. Ufullstendige kliniske opplysninger kan vanskeliggjøre analysen og gi et dårligere svar tilbake. Se for øvrig ovenstående vedr. biopsimateriale.
Standard forsendelse av prøvemateriale
Veiledning for innsendende lege/sykehus for kromosomundersøkelse av benmarg, blod og vev samt tilsending av transportrør med medium kan fåes ved henvendelse til laboratoriet som skal utføre undersøkelsen, se ovenfor. Cytogenetisk undersøkelse av vev foretas som nevnt kun ved sykehus i Oslo og Bergen. Prøver mottas mandag–torsdag. Prøver mottatt til andre tider kan ikke tas hånd om optimalt. Patologen bør ordne forsendelse av vevet til cytogenetisk undersøkelse siden han har oversikt over vevets totale størrelse og hvor mye vev som er nødvendig for de ulike diagnostiske undersøkelsene. Blod- eller benmargsprøve sendes så snart som mulig på transportrør ved romtemperatur (bruk termos vintertid) til Laboratorium for Cytogenetikk, helst slik at den er laboratoriet i hende samme dag senest en time før arbeidsdagens slutt.