CT toraks og øvre abdomen
CT toraks og øvre abdomen med intravenøst kontrastmiddel utføres hos alle pasienter med begrunnet mistenkt lungekreft som er aktuelle for behandling.
Undersøkelsen utføres før bronkoskopi og annen prøvetaking for cytologisk/histologisk diagnostikk. Ved begrunnet mistanke om lungekreft bør ventetiden på CT ikke være mer enn noen få dager. Hos disse pasientene vil nytten av røntgen toraks primært være å kunne planlegge CT best mulig, for eksempel ved å påvise pleuravæske som med fordel kan tappes før CT.
Anbefalt CT-protokoll CT toraks og øvre abdomen
- Peroral kontrast
0,5 l vann peroralt 15-30 minutter før undersøkelsen. - Intravenøst kontrastmiddel
2 ml/kg (ved konsentrasjon 350 mg I/ml), injeksjonshastighet 4 ml/s.Kontrastmengden kan justeres til 1,5 ml/kg ved overvekt og 2,5 ml/kg for atleter. - Forsinkelse
Scan startes ca 85 sekunder etter påbegynt kontrastmiddelinjeksjon (gir portovenøs fase).Eksempel: 80 kg pasient får 160 ml kontrast med hastighet 4 ml/s i løpet av 40 sekunder. Bildeopptak starter da 45 sekunder etter all kontrast har blitt injisert - Scanområde
Fra krikoidbrusken og forbi høyre leverspiss. - Rekonstruksjoner
- Aksial-, koronal- og sagittalplan med snittykkelse 2-3 mm i bløtdelsalgoritme
- Aksial serie over lungene med snittykkelse 0,6-1 mm i lunge og bløtdelsalgoritme
- MIP i koronarplan og/eller aksialplan
- + eventuelt ytterligere rekonstruksjoner / CAD i henhold til lokal rutine
Kommentar:
En venøs kontrastfase over toraks er fordelaktig for vurdering av sykdomsstadium og da spesielt for identifisering av henfall i lymfeknuter samt affeksjon av toraksvegg og venøse strukturer (Larici et al., 2021). Anbefalt protokoll gir også kontrastfremstilling av arterier, et bedre skille mellom tumor og atelektase, en bedre framstilling av pleura samt en bedre framstilling av supraklavikularregionen. Protokollen sparer også 1/3 av stråledosen sammenlignet med separate undersøkelser av toraks og øvre abdomen. Forutsatt venøs fremstilling i toraks og abdomen kan undersøkelsen alternativt utføres med testbolus eller «bolustracking».
Beskrivelse av CT toraks og øvre abdomen
Beskrivelsen fokuseres på de forhold som har betydning for stadieinndeling i henhold til gjeldende TNM-utgave.
Følgende bør beskrives:
- Størrelse, morfologi og beliggenhet av tumor samt eventuell affeksjon av nabostrukturer
- Mistanke om patologiske lymfeknuter med angivelse av størrelse i mm og stasjonsnummer
- Effusjon i pleura eller perikard
- Metastasesuspekte forandringer
- Usikre funn hvor det er indikasjon for ytterligere bildediagnostikk
- Komorbiditet som kan ha betydning for videre utredning / operabilitet
- Ved høy mistanke om primær lungecancer: anbefales det å anslå en tentativ TNM (den endelige cTNM settes på MDT-møtet når all utredning er ferdig)
Kommentar:
Den lengste diameteren av den solide tumorkomponenten målt i lungevindu, uavhengig av plan, er avgjørende for T-stadium (obs dette skiller seg fra målinger gjort ved funn av tilfeldige noduli, se pkt 1.7). Unntak er rene mattglasslesjoner som måler >30mm, disse angis som T1a. Spikulering og postobstruktive atelektaser skal ikke være en del av rapportert størrelse, men beskrives. Tetthet av tumor (solid / delvis solid / mattglass) beskrives og, når relevant, størrelsen på mattglasskomponenten.
Vurderingen av affeksjon av nabostrukturer og da spesielt innvekst i pleura (T2), mediastinum (T4) og toraksvegg (T3) kan være vanskelig på CT, men et sikkert funn er eksempelvis destruksjon av costa. Ved usikkerhet om innvekst velges alltid laveste aktuelle T-kategori.
Lymfeknuter rapporteres med kortaksemål med lokalisasjon i henhold til IASLC Lymph Node Map (se Figur 9) (El-Sherief, Lau, Carter, & Wu, 2018). Patologisk forstørrede lymfeknuter er generelt definert som kortaksediameter >10 mm. CT har en begrenset verdi for å skille mellom maligne og benigne lymfeknuter med en sensitivitet på ca 55% og spesifisitet på ca 81% (Silvestri et al., 2013), her har funn ved PET/CT/EBUS en sentral rolle.
Ved histologisk verifisert primær lungecancer bør CT-beskrivelsen inneholde en tentativ TNM. Ved tvil om riktig T eller N verdi brukes laveste (minst avanserte) kategori. Om en eller flere av kategoriene, som eksempelvis en lymfeknute, er radiologisk usikker kan dette beskrives «tentativ T3NxM0» eller «antatt benign lymfeknute i venstre hilus tentativt T3N0M0».
Undersøkelsen bør beskrives i løpet av to virkedager.
PET/CT
Generelle betraktninger
Positron emisjonstomografi (PET) med [18F]-fluoro-2-deoxy-glucose (FDG) kombinert med CT er en grunnleggende undersøkelse ved utredning av lungekreft. PET kan kombineres med lavdose CT, diagnostisk CT med eller uten intravenøs kontrast, og en kan supplere med egen serie av toraks i full inspirasjon. Grad av FDG-opptak, målt i «standardized uptake value (SUV)» gjenspeiler cellenes metabolske aktivitet i form av økt glukoseforbruk. De fleste maligne svulster i lungeparenkymet demonstrerer økt opptak av FDG med noen unntak (se "Vurdering av T-stadium"). Vev med fysiologisk høyt glukoseforbruk kan eksempelvis være hjerne, hjerte, gastrointestinaltraktus og muskulatur under/etter aktivitet. FDG utskilles primært via urinveiene (Kandathil & Subramaniam, 2022).
FDG er ikke en malignitetsspesifikk tracer og det er mange andre tilstander som kan gi økt opptak, eksempelvis infeksjoner, inflammasjoner eller benigne lesjoner. Det er derfor viktig å ha lav terskel for avklaring av «PET-positive» funn. Videre er det også mange faktorer som kan ha innvirkning på graden av opptak som kan bidra til en underestimering eller overestimering av graden av opptak.
Dersom tilgjengelig bør det tilstrebes å utføre respirasjonstrigget FDG-PET for å unngå effekten av pusteartefakter på opptaket i lesjoner. Dette er spesielt viktig for små lesjoner (<10 mm), og lesjoner som ligger i midtre/basale deler av lungene eller i lever. Nåværende (2017) Fleischner retningslinjer anbefaler FDG-PET for tilfeldig påvist solid pulmonal nodulus (SPN) > 8 mm (eller delvis solide lesjoner med solid komponent > 8 mm), mens nåværende (2015) British Thoracic Society (BTS) retningslinjer har samme størrelseskriterium, men inkorporerer en risikostratifisering før vurdering med FDG-PET. (Callister et al., 2015; MacMahon et al., 2017). American College of Chest Physicians (AACP) anbefaler FDG-PET hos personer med lav – moderat pre-test sannsynlighet (5 – 65%) for lungekreft med «indeterminate SPN» på CT, men disse krever minst to års oppfølging med CT for å bekrefte at det ikke foreligger malignitet dersom FDG-PET ikke demonstrerer økt opptak. For personer med samme kriterier, men med veldig lav risiko (< 5%) anbefales ikke FDG-PET for karakterisering (Gould et al., 2013). I SPUTNIK-studien var anbefalingen å vurdere opptaket i forhold til størrelsen av lesjonen, dvs. de senket kriteriet for malign/benign i mindre noduli da det er kjent at disse kan ha underestimert opptak (Weir-McCall et al., 2021). Generelt vil underestimeringen av opptaket være mer sannsynlig jo mindre lesjonen er. En må derfor ta med andre parametere enn kun opptak i vurderingen, slik som størrelse, morfologi, veksthastighet, og tetthet på CT (Kandathil & Subramaniam, 2022; Rogasch et al., 2022).
Den skriftlige rapporten fra PET-undersøkelsen skal inneholde en kvalitativ vurdering av opptaket i forhold til opptaket i blod, lever og cerebral korteks, samt en vurdering av sannsynlighet for malignitet basert på en 5-punkts Likertskala. Om en lesjon er malign eller ikke er en sammensatt vurdering og kan ikke bare baseres på økt opptak. Vurderingen bør være i tett samarbeid med radiolog. I mange studier benyttes enten opptak over blodbakgrunn, opptak over leverbakgrunn eller SUVmax >2.5 som definisjon på malignitet. I en klinisk hverdag benyttes ikke SUV-parametere for å definere malignitet.
Vurdering av T-stadium
For vurdering av T-stadium benyttes CT (som beskrevet i avsnitt "CT toraks og øvre abdomen"). FDG PET vil ofte underestimere tumorvolum, men kan bidra med å skille metabolsk aktivt tumorvolum fra atelektase og nekrose. Dette er nyttig ved perkutan biopsi og ved inntegning av strålefelt.
Flere studier har demonstrert varierende grad av opptak i primærtumor på bakgrunn av histologisk undertype. Plateepitelkarsinom har som regel høyt opptak på nivå med cerebral korteks. Visse subtyper av adenokarsinom har opptak mellom blod og lever, eller lavere slik som ved lepidisk vekstmønster (Lococo et al., 2022). Mucinøse adenokarsinomer har ofte lavt opptak men kan noen ganger ha høyt opptak på nivå med platepitelkarsinomer (Suárez-Piñera et al., 2018).
Småcellet karsinom (SCLC) og storcellet karsinom (LCNEC) har som regel høyt opptak på nivå som plateepitelkarsinomer.
Karsinoider har oftest lavt opptak men kan også helt mangle FDG-opptak, noe som gjør det vanskelig å skille dem fra benigne svulster, eksempelvis hamartomer (Dam et al., 2023; Tatcı, Özmen, Öztürk, & Demirağ, 2021).
Vurdering av N-stadium
FDG PET øker sensitiviteten og spesifisiteten i forhold til CT alene med tanke på diagnostikk av lymfeknutemetastaser i mediastinum. Sensitiviteten og spesifisiteten i forskjellige studier er ganske sprikende dels på grunn av forskjellige definisjoner av malign/ikke-malign (se tidligere avsnitt), og i hvilken grad tuberkulose er endemisk i landet hvor studien er utført. I nyere metaanalyser er sensitivitet og spesifisitet funnet å ligge på henholdsvis 77% og 86%. Men samtidig er den falsk negative og falsk positive andelen vist å være henholdsvis 7%-16% og 45%-48%. En annen studie fant at ved PET N0 sykdom var andelen okkult N1 sykdom 8% og N2 sykdom 10% (Dunne, Fick, & Jones, 2023). I nåværende retningslinjer fra European Society of Thoracic Surgeons/European Society for Medical Oncology (ESTS/ESMO) defineres «PET-positive» lymfeknuter som de med opptak over blodbakgrunn, og dermed er EBUS/EUS anbefalingene for verifisering basert på dette. For å øke sensitiviteten og spesifisiteten for deteksjon av mediastinale lymfeknutemetastaser har flere studier sett på andre prediktorer for okkulte N2-knuter slik som tumorhistologi, tumors differensieringsgrad, tumorstørrelse, tumoropptak på FDG PET, beliggenhet i lungeparenchymet, opptak i lymfeknuten på FDG PET og/eller størrelse på lymfeknuten på CT, uten at det foreligger overbevisende data for den ene eller andre parameteren. Generelt har FDG PET en høy negativ prediktiv verdi for å utelukke lymfeknutemetastaser, mens den positive prediktive verdien for å påvise lymfeknutemetastaser er lavere, da det ikke er like lett å skille mellom inflammatoriske og neoplastiske lymfeknuter. (Al-Ibraheem et al., 2021; Damirov, Büsing, et al., 2023; Damirov, Stoleriu, et al., 2023; X. Liao et al., 2023; Owens, Hindocha, Lee, Millard, & Sharma, 2023; Rogasch et al., 2021; Seol, Kim, & Kim, 2021).
I løpet av de siste årene har det kommet flere studier som diskuterer nytteverdien av FDG PET ved primære subsolide lesjoner < 3 cm. Lavt opptak i primærtumor gjør det vanskelig å skille mellom inflammasjon og malignitet spesielt der hvor det ikke foreligger noen observasjonstid. Videre er det en lav forekomst av okkulte lymfeknutemetastaser hos disse pasientene i tillegg til at lavt opptak i primærtumor gir en lavere sensitivitet for deteksjon av lymfeknutemetastaser. Således vil FDG-PET i disse tilfellene ikke kunne bidra til å avklare N-stadium før kurativ behandling. For pasienter med ren mattglassfortetning eller klinisk stadium IA med perifer tumor uten øvrige malignitetssuspekte funn på CT skriver American College of Chest Physicians (AACP) i sine retningslinjer at disse pasientene ikke trenger FDG PET før kurativ behandling. Samtidig anbefaler en konsensusuttalelse fra American Association for Thoracic Surgery (AATS) FDG PET for alle pasienter med nydiagnostisert lungekreft. Man må derfor avvente større studier og/eller oppdaterte ESTS/ESMO-retningslinjer for endelig avklaring om hvordan FDG PET bør inngå i utredning av subsolide lesjoner. I mellomtiden anbefales å gjøre PET/CT rutinemessig på alle med tentativ kurabel sykdom, med unntak av rene mattglasslesjoner (Kidane et al., 2023; Lococo et al., 2022; Pencharz et al., 2022; Y. J. Suh et al., 2020).
Vurdering av M-stadium
For utredning av fjernmetastaser (M-status) bidrar FDG PET signifikant i forhold til CT og øker sjansen for å finne metastaser. Dette er en av grunnene til at FDG PET/CT anbefales ved utredning av alle pasienter som i utgangspunktet er oppfattet å ha kurabel lungekreft. Ved erkjent stadium IV kreft gir den lite tilleggsinformasjon som vil påvirke behandlingsvalg.
Sensitiviteten og spesifisiteten er høy for påvisning av lunge-, pleura-, binyre-, lever- og benmargsmetastaser. For benmargsmetastaser øker den positive prediktive verdien signifikant dersom det foreligger korresponderende funn ved CT, men sannsynligheten er fortsatt høy ved manglende osteoblastisk reaksjon i/omkring metastasen. Skjelettscintigrafi har ingen rutinemessig plass i utredningen av skjelettmetastaser da PET/CT har høyere sensitivitet og spesifisitet. På grunn av høyt fysiologisk opptak i hjernevevet er sensitiviteten lav for deteksjon av hjernemetastaser og MR caput er derfor førstevalget ved utredning med tanke på dette (Chakrabarty, Mahajan, Patil, Noronha, & Prabhash, 2023). Noen ganger kan en dog oppdage hjernemetastaser ved FDG PET på grunn av manglende opptak i et større område med ødem omkring en hjernemetastase (Kandathil & Subramaniam, 2022; Owens et al., 2023).
PET/CT ved karsinoider
Nyere studier har demonstrert opptak ved FDG PET i opptil 93% av typiske karsinoider og 96% av atypiske karsinoider hvorfor FDG PET anbefales også i utredningen av karsinoider. Ved mistanke om karsinoid på CT kan en imidlertid vurdere somatostatinreseptor (SSR) avbildning med [68Ga]Ga-DOTA-TOC som førstevalg fremfor FDG PET i utredningen. Sammen med [68Ga]Ga-DOTA-TATE eller [64Cu]Cu-DOTA-TATE omtales [68Ga]Ga-DOTA-TOC som SSR PET. SSR PET har en høy sensitivitet og spesifisitet for karsinoider, men kan ikke skille mellom typiske- eller atypiske karsinoider. Typiske karsinoider har vanligvis høyere opptak ved SSR PET enn atypiske karsinoider, mens atypiske karsinoider vanligvis har høyere opptak ved FDG PET enn typiske karsinoider. Dette fordi at etter hvert som karsinoider de-differensierer så mister de ekspresjon av somatostatinreseptorer på celleoverflaten som gjør at opptaket ved SSR-PET blir lavere og opptaket ved FDG PET blir høyere pga. økt glukoseforbruk
Er FDG PET utført før histologisk bekreftelse av karsinoid anbefales supplement med SSR PET pre-operativt (dersom mulig) eller post-operativt. Ifølge litteraturen påvises metastaser utenfor toraks i ca. 10% av pasienter med karsinoid og funn av metastaser har en behandlingsmessig konsekvens i ca. 25% av pasientene. Atypiske karsinoider har en høyere sannsynlighet for metastasering en typiske karsinoider. Det er manglende data på nytten av SSR PET ved små typiske karsinoider. Er SSR PET utført før histologisk diagnose foreligger bør FDG PET utføres i tillegg ved mistanke om atypisk karsinoid (Ki-67 >4-5%) eller dersom SSR PET ikke demonstrerer økt opptak i primærtumor.
På grunn av lav sensitivitet anbefales ikke konvensjonell somatostatinreseptorscintigrafi med oktreotidpreparater. Avbildning med både SSR PET og FDG PET anbefales også dersom pasienten er en kandidat for peptidreseptor radionuklideterapi (PRRT) (Baudin, Caplin, Garcia-Carbonero, Fazio, Ferolla, Filosso, Frilling, de Herder, Hörsch, Knigge, Korse, Lim, Lombard-Bohas, Pavel, Scoazec, Sundin, & Berruti, 2021; Dam et al., 2023; Grøndahl et al., 2019; Prosperi et al., 2023).
PET/CT i oppfølging av behandling
Rutinemessig oppfølging med FDG-PET under- eller etter gjennomgått behandling er ikke anbefalt. FDG PET kan bidra i tilfeller der CT er inkonklusiv, og må vurderes i hvert enkelt tilfelle. I disse tilfellene er det viktig at histologi fra tidligere lungekreft opplyses om i henvisningen på grunn av varierende opptak i primærtumor, som nevnt tidligere. I tillegg er det viktig å opplyse om type pågående behandling og hvilket intervall behandlingen gis slik at FDG-PET ikke blir tatt for tett opptil sist behandling. Generelt bør en ikke utføre FDG PET i løpet av de første tre til seks månedene etter stråleterapi med spørsmål om lokalt residiv da FDG-opptaket stort sett er høyt på grunn av inflammasjon. Trolig er også nytteverdien liten i løpet av de 12 første månedene dersom en tar i betraktning tidspunktet for utvikling av residiv, men dette er avhengig av initialt stadium. Etter stråleterapi kan det foreligge økt FDG-opptak på grunn av inflammasjon i bestrålte områder i opptil to år som må tas med i vurderingen av lokalt residiv med FDG-PET. For de pasientene som får immunterapi var det nylig (2022) publisert retningslinjer fra den europeiske nukleærmedisinske organisasjonen EANM som omtaler fordeler og ulemper med FDG PET ved responsevaluering hos disse pasientene. Det foreligger ingen spesifikke anbefalte metabolske responskriterier, og problemet med inflammasjon er større på grunn av immunmedierte bivirkninger som kan gjøre tolkningen vanskelig (Castello et al., 2020; Kandathil et al., 2018).
PET/CT oppsummert
- FDG PET anbefales ved utredning av primær lungekreft der kurativ intensjon enten med kirurgi, stråleterapi eller kjemoradioterapi er til stede.
- FDG PET anbefales ved karakterisering av solide pulmonale noduli og delvis solide lesjoner med solid komponent. Sannsynlighet for underestimering av opptaket øker jo mindre størrelsen på lesjonen er.
- FDG PET er ikke anbefalt ved rene mattglasslesjoner, med unntak hvor lesjonen er > 30 mm (T1a) og pasienten utredes med tanke på kurativ behandling.
- SSR PET bør vurderes fremfor FDG PET ved mistanke om karsinoid på CT.
- SSR PET anbefales ved histologisk verifisert karsinoid.
- FDG PET bør vurderes ved atypisk karsinoid, Ki-67 ³ 10% eller dersom SSR-PET ikke demonstrerer økt opptak i primærtumor.
- Skjelettscintigrafi er underlegen FDG PET og har ingen rutinemessig plass i utredningen av benmargsmetastaser.
- FDG PET anbefales ikke rutinemessig i oppfølgingen etter behandling.
- FDG PET kan være nyttig ved vurdering av responsevaluering hvor CT er inkonklusiv, og ved residiv etter både kirurgi og stråleterapi.
MR-undersøkelser
- MR caput
Når det er indisert å utelukke cerebrale metastaser.Anbefales vurdert ved tentativt stadium II- IV NSCLC og alle SCLC. Lav terskel for øvrig ved suspekte CNS-symptomer. Forekomsten av okkulte hjernemetastaser kan være høy, spesielt i stadium III (B. Yang et al., 2019). Risikoen er størst hos pasienter med adenokarsinom (M. Kim et al., 2020). Spesielt viktig hos pasienter i stadium IV som er aktuelle for målrettet behandling. I stadium IV forekommer hjernemetastaser hos 29% av pasientene ved diagnosetidspunktet, både med og uten påvist spesifikke mutasjoner (EGFR og ROS 29%, KRAS 30% og ALK 35% (Chakrabarty et al., 2023; Gillespie et al., 2023; Schoenmaekers, Dingemans, & Hendriks, 2018), og tilsvarende tall er sett i Norge (Nasjonalt kvalitetsregister for lungekreft (fhi.no)). - MR lever
Uavklarte leverlesjoner som kan representere metastaser. Små (˂1 cm) lavtette lesjoner representerer mest sannsynlig benigne cyster også hos pasienter med kjent kreftsykdom (Schwartz, Gandras, Colangelo, Ercolani, & Panicek, 1999). Indikasjon for mer sikker karakterisering med MR vurderes på individnivå. - MR binyrer
Uavklarte funn ved flerfase CT binyrer eller ved kontraindikasjon for jodholdig kontrast. - MR columna/bekken
Ved usikkerhet om skjelettmetastaser / avklaring av nevrologiske utfall. - MR plexus brachialis
Mistanke om affeksjon av plexus brachialis ved sulcus superior-(Pancoast-) tumor
CT-undersøkelser utover CT toraks og øvre abdomen
- CT binyrer
Uavklarte lesjoner i binyrer. Initialt utføres serie uten intravenøs kontrast. Hvis det ikke påvises fettinnhold (≤10 HU) kompletteres med flerfaset kontrastserie (P. T. Johnson, Horton, & Fishman, 2009). Metastaser har forsinket utvasking av kontrast sammenlignet med adenomer. - CT lever (flerfaset)
Uavklarte lesjoner i lever som er uegnet for ultralyd og når MR er kontraindisert. - CT caput
CT med kontrast har en sensitivitet på 92% for å oppdage hjernemetastaser. Faren for å overse små metastaser, leptomeningeal spredning og vansker med å skille metastaser i dura fra meningiomer gjør at MR caput er førstevalget ved utredning av hjerne metastaser (Chakrabarty et al., 2023). Unntak kan være hos pasienter med klaustrofobi, MR-inkompatibel pacemaker, ved mistanke om livstruende cerebrale situasjoner eller når MR ikke er tilgjengelig. - Prøvetaking
Veiledning ved biopsi av primærtumor og mulige metastaser.
Ultralyd
- Ultralyd lever
Uavklarte lesjoner dersom egnet med hensyn til antall/lokalisasjon/habitus.Vurdering av leverparenkymet når jodholdig intravenøs kontrast og/eller MR er kontraindisert. - Ultralyd toraks
Kan eventuelt avklare om det foreligger innvekst i brystvegg (lungeglidning). - Prøvetaking
Veiledning ved pleurapunksjon og biopsi av tumor/lymfeknuter.
Bronkoskopi
Det diagnostiske utbytte ved fleksibel bronkoskopi avhenger av lungelesjonens lokalisasjon og størrelse. En metaanalyse viser en sensitivitet på 88% ved sentrale, endoskopisk synlige lesjoner, mens den er betydelig lavere ved perifere, ikke synlige tumorer. Henholdsvis 63% og 34% ved lesjoner over eller under 2 cm i diameter. Sensitiviteten bedres av antall metoder brukt i prøvetakingen (biopsi, børste, skylleprøver, transbronkial finnål), antall biopsier (anbefalt minst 3) og bruk av gjennomlysning ved perifere lesjoner (Rivera, Mehta, & Wahidi, 2013). I øvede hender kan radial EBUS og/eller navigasjonsbronkoskopi øke treffsikkerheten ved perifere lesjoner (se avsnittene "Bronkoskopi", "Radial endobronkial ultralyd" og "Elektromagnetisk navigasjonsbronkoskopi").
Ved bronkoskopi inspiseres stemmebåndenes bevegelighet og symmetri/asymmetri. Tegn til stemmebåndsparese kan tale for mediastinal tumorinfiltrasjon eller spredning til mediastinal lymfeknute. Ved en sentral, synlig bronkial tumor anbefales foto- og videodokumentasjon til hjelp for kirurgens vurdering av eventuell operasjonsteknisk tilnærming. Slimhinnebiopsier i flere nivå proksimalt for tumor for å påvise ev. submukøs tumorvekst kan være aktuelt dersom dette kan ha konsekvens for operasjonsteknikken (mulighet for bronkoplastikk eller sleeve-reseksjon vs pneumektomi). Angi om tumor involverer hovedbronkus eller carina (henholdsvis T2 og T4)
Bronkoskopi utføres vanligvis i lokalanestesi og mild sedasjon og er sjeldent beheftet med alvorlige komplikasjoner og pas kan utskrives etter få timer. Pneumotoraks ses i 1-6% av tilfellene etter transbronkial biopsi. Relative kontraindikasjoner til prosedyren inkludert prøvetaking er få og inkluderer: hypoksemi tross oksygentilskudd, intraktabel blødningsforstyrrelse (obs blodfortynnende medikamenter), alvorlig pulmonal hypertensjon, kardiovaskulær ustabilitet samt akutt hyperkapni.
Radial endobronkial ultralyd
Radial endobronkial ultralyd (R-EBUS) er en bronkoskopisk modalitet som benyttes til å lokalisere og vurdere perifere lungelesjoner. Under røntgengjennomlysning føres et kateter med en radial skannende ultralydprobe ned via bronkoskopets arbeidskanal ut til det relevante området, typisk et subsegment, hvor lesjonen er lokalisert. Når proben befinner seg i egnet lokalisasjon bedømt ut fra gjennomlysning og ultralydbilde, erstattes ultralydproben med en børste, finnål eller biopsitang hvoretter prøven tas. Undersøkelsen kan planlegges ut fra virtuell 3D CT bronkoskopi (se avsnitt "Bronkoskopi"). Sensitiviteten er i en metaanalyse beskrevet til rundt 70%, men varier fra 50 – 90% i enkeltstudier (Ali et al., 2017). Faktorer assosiert med bedre diagnostisk utbytte er lesjonens størrelse samt et konsentrisk «bronchus sign» i ultralydbildet. Atelektase i området kan gjøre tolkning av ultralydbildet vanskelig. Det er også en tendens til at lokal atelektase utvikles til lengre prosedyren pågår. De vanligste komplikasjoner til prosedyren er små blødninger samt pneumotoraks. Sistnevnte risiko er rundt 1%, noe som er lavere enn ved tradisjonelle transbronkiale biopsier utført i gjennomlysning.
Elektromagnetisk navigasjonsbronkoskopi
Elektromagnetisk navigasjonsbronkoskopi (ENB) består av en kombinasjon av fleksibel bronkoskopi, et virtuell 3D bilde av bronkialtreet og elektromagnetisk navigasjon.
Ruten ut til den perifere lungelesjon planlegges i et virtuelt 3D-bronkogram basert på pasientens CT toraks og egen software. Pasienten leires på et «magnetfelt» og via bronkoskopet innføres et kateter med elektromagnetisk probe og skopet navigeres via et GPS-liknende prinsipp frem til den perifere lungelesjon. Plasseringen kan bekreftes ved radial-EBUS og/eller gjennomlysning. Deretter fjernes proben mens man lar kateteret ligge på plass og instrumenter til biopsi og/eller cytologi føres inn til lesjonen.
ENB har i en metaanalyse vist en sensitivitet på 77 % ved perifere maligne lesjoner (Folch et al., 2020). Nyere systemer med bruk av tynnere skop, har vist en tilsvarende sensitivitet (Y. Li et al., 2023). Faktorer assosiert med høyere diagnostisk utbytte er størrelse av lungelesjon, lokalisasjon til over- eller midtlapp og samtidig bruk av R-EBUS. Det diagnostiske utbytte er som ved andre prosedyre avhengig av bronkoskopørens erfaring.
ENB kan også brukes til merking av lungelesjon med blekk eller coil preoperativt med tanke på å lette lokalisasjon ved kilereseksjon eller stereotaktisk bestråling.
Komplikasjoner relatert til ENB er blødninger (< 1 %) og pneumotoraks (2 %) (Folch et al., 2020).
Endobronkial ultralyd (EBUS)
EBUS brukes om to ulike undersøkelsesmodaliteter, radial EBUS og lineær EBUS. Radial EBUS omtales i avsnitt "Radial endobronkial ultralyd", mens lineær EBUS omtales her.
Ved lineær EBUS vurderes lymfeknuter langs trakea og de største bronkiene og ved EBUS-TBF (transbronkial finnål) utføres prøvetaking av lymfeknutene. EBUS har erstattet mediastinoskopi og er nå standarden for diagnostikk av mediastinale lymfeknuter (Dunne et al., 2023). Undersøkelsen kan utføres både på «våken-sederte» og pasienter i narkose. Ved narkose anbefales bruk av larynksmaske. Undersøkelsen anbefales utført av dedikerte leger da pasientvolum er viktig for trening og erfaring.
Finnålsaspirat ved hjelp av EBUS-nålene med 21 eller 22 G tas både til utstryk til umiddelbar vurdering (ROSE, se nedenfor) og settes på saltvann for å lage celleblokk, noe som tillater videre undersøkelser med immunhistokjemi (se 6.9.8). Ofte kan en på denne måten også få nok materiale for molekylærpatologiske undersøkelser. Det er også mulig å dytte materiale forsiktig ut av nålen ved hjelp av mandrengen, legge materialet på formalin og på denne måten sikre seg små sammenhengende vevsbrokker (finnålsbiopsi) for videre diagnostikk.
EBUS er viktig for å skille mellom teknisk operable og ikke-operable pasienter og bør utføres dersom CT toraks og/eller PET/CT gir mistanke om stadium II og III lungekreft. Ved planlagt stereotaksi av primær tumor eller neo-adjuvant behandling, anbefales det å utføre EBUS for å bekrefte stadium I, og slik unngå feilbehandling. Alle sykehus som driver med lungekreftutredning må ha tilgang til EBUS, enten i eget hus eller hos samarbeidende sykehus.
CT og FDG PET er ikke sensitive nok til å fange opp tidlig mediastinal lymfeknutespredning, eller spesifikke nok til å skille mellom benigne og maligne lymfeknuter. En lengste kortaksediameter på 10 mm i aksial-planet brukes ofte i bildediagnostikk for å skille mellom «normale» og «malignitetssuspekte» lymfeknuter, men i studier er det funnet at 21 % av knuter < 10 mm er maligne og at 40 % av knuter > 10 mm er benigne. Andre tilstander som hjertesvikt, inflammasjon og paramalign reaksjon kan gi forstørrede lymfeknuter på CT (Dunne et al., 2023). Inflammatoriske tilstander kan også gi økt opptak ved PET/CT.
Funn på CT toraks og FDG PET brukes i planleggingen av hvilke lymfeknuter som skal undersøkes. Hvis problemstillingen kun er å få en diagnose, eksempelvis ved utbredt sykdom, kan man stikke i den lymfeknuten som er mest suspekt og enklest tilgjengelig (selektiv EBUS). Hvis problemstillingen er å kartlegge utbredelsen av sykdommen anbefales det at man gjør en systematisk, forhåndsbestemt (ut fra CT og FDG PET) EBUS-TBF av ≥ 3 stasjoner inkludert stasjon 7 (Leong, Loveland, Gorelik, Irving, & Steinfort, 2019). Videre at man tar prøver av stasjoner i rekkefølgen N3 - N2 - N1 for å unngå forurensning av maligne celler i finnålen. Det anbefales å gjøre minimum tre stikk i hver knute da det bør foreligge tre representative negative prøver før man erklærer lymfeknuten for benign (De Leyn et al., 2014). Før prøvetakingen er anbefales det at man systematisk ser over aktuelle lymfeknutestasjoner for å kartlegge forholdene og se hvilke stasjoner som er mest suspekte og best egnede. Dette fordi undersøkelsen kan bli avbrutt av pasienten før fullført prøvetaking.
Ved å ha tilgang til ROSE (rapid on site evaluation) i form av cytolog eller screeningsteknikker kan man med en gang sjekke om man har truffet og fått representativt materiale. Dette kan både forkorte prosedyren og minske sjansen for at undersøkelsen må gjentas (Silvestri et al., 2013).
I følgende fire situasjoner bør EBUS alltid vurderes:
- Ved funn av forstørrede hilære lymfeknuter (N1) og/eller hilære knuter med økt opptak på FDG PET.
- Ved PET-negative primærtumorer av en viss størrelse.
- Ved primærtumor ≥ 3 cm.
- Ved sentral tumor.
I disse tilfellene er det en 6 %-30 % sjanse for å finne spredning til lymfeknutene (Vilmann et al., 2015). En systematisk gjennomgang viser at forekomsten av okkult N2 ved sannsynlig N0/N1(bedømt ut fra CT og/eller FDG PET), er 14 -21 % (Dunne et al., 2023). EBUS kan også vurderes når det kan få avgjørende betydning for planleggingen av mediastinale strålefelt.
EBUS er ikke ansett som nødvendig ved perifer primærtumor < 3 cm når CT og/eller FDG PET ikke gir mistanke om maligne lymfeknuter. Dette fordi sannsynligheten for å finne malign(e) lymfeknute(r) er < 6 % (Vilmann et al., 2015). I tilfeller hvor det er påvist fjernmetastaser (M+) vil EBUS oftest ikke ha noen tilleggsverdi.
EBUS kan skille lymfeknuter og oppfyllinger fra blodkar, og det kan også beskrive ultrasonografiske trekk som størrelse, form, avgrensing, heterogenitet, sentral hilusstruktur og nekrose. Disse egenskapene ved lymfeknutene kan brukes til støtte i vurderingen av malignitet hvis en knute er vanskelig tilgjengelig, men kriteriene er ikke sikre nok til å unnlate prøvetaking hvis det er teknisk mulig (Silvestri et al., 2013).
De mediastinale lymfeknutestasjoner 8, 9 og 3p kan ikke nås fra trakea, men er tilgjengelige fra øsofagus. I situasjoner hvor avklaring av disse stasjonene er nødvendig for stadieinndeling bør man derfor gjøre endoskopisk ultralyd i øsofagus (EUS) (Vilmann et al., 2015). I øvede hender kan også disse stasjonene nås med EBUS-bronkoskopet, såkalt EUS-B, gjerne i samme seanse som man undersøker mediastinum endobronkialt. EUS og EUS-B kan også være et supplement i stasjonene 2R/L, 4L og 7.
EBUS-bronkoskopet kan (som EUS) også nå venstre binyre for prøvetaking.
Ved mistanke om N3 knuter er vanligvis ikke EBUS indisert med mindre man mistenker sarkoidose, reaktive eller infeksiøse knuter og klarering av knutene vil være avgjørende for valg av behandling (kirurgi eller begrensning av strålefelt).
CT- og ultralydveiledet veiledet biopsi av primærtumor
Det bør tas CT-veiledet transtorakal biopsi av pasienter når annen diagnostisk avklaring ikke er mulig og når svaret er avgjørende for diagnose og/eller valg av behandling. Oftest gjelder dette perifere lesjoner men også mer sentrale lesjoner som ikke nås endoksopisk bør vurderes. Metaanalyser viser en sensitivitet på rundt 90 % både for biopsier (20-18 Gauge nåler) og finnålsaspirater (25-22 Gauge nåler) mens nålebiopsier noe oftere gir nok materiale (96 % vs 86 %) (Y. Li, Yang, Huang, & Cao, 2022).
Tilstedeværende cytologiservice, ROSE (rapid on site evaluation), har vist en signifikant høyere sensitivitet (+ 10 %) uten at det førte til hverken forlengelse av prosedyretiden eller flere komplikasjoner (D. Wu, Liu, Wang, Huang, & Xia, 2023). For diagnostikk av lesjoner som ligger inntil eller i pleura er ultralydveiledet punksjon vist å være like sensitiv som CT-veiledet punksjon, men med lavere komplikasjonsfare (X. Li & Kong, 2023).
Relative kontraindikasjoner mot biopsi er sterkt redusert lungefunksjon, pulmonal hypertensjon, koagulasjonsforstyrrelser, tidligere pneumektomi og mekanisk ventilasjon. Absolutt kontraindikasjon er en pasient som ikke samarbeider. Om pasienten bruker antikoagulantia bør disse nulles en uke før prosedyren og eventuelt erstattes med småmolekylært heparin s.c. Ubiopsert tumor kan være aktuell for stereotaktisk stråleterapi, om det sees radiologisk vekst kombinert med PET-positivitet (se avsnitt om sterotaktisk strålebehandling).
En av de vanligste komplikasjonene til CT-veiledet biopsi er blødning i lungeparenkymet (ca 20 %) med symptomer som akutt hoste og hemoptyse. Disse er som regel selvbegrensende. En metaanalyse viser at pneumotoraks etter CT-veiledet biopsi oppstår i 25,9 % av tilfellene, men at spredningen er stor mellom ulike studier, 4,3 % til 52,9 %. Til gjengjeld er behovet for toraksdren lavt, 6,9 % (0-15 %) (Huo, Chan, Habib, Lui, & Ridley, 2020).
Mulige risikofaktorer for å utvikle pneumotoraks er emfysem, transfissural tilgang, stor kaliber av biopsinål (≤ 18 gauge), multiple punksjoner av pleura, små noduli (≤ 2 cm) og dybden inn til lesjonen (Huo et al., 2020). Pneumotoraks oppstår ofte direkte eller kort tid etter biopsi, forsinket pneumotoraks er sjelden men forekommer og oftere ved punksjon i overlappene.
Blødning fra intercostalarterier til pleura er sjeldent men kan i alvorlige tilfeller kreve intervensjon. Dødsfall etter transtorakal lungebiopsi er svært sjelden, 0,07 % i en japansk studie (Tomiyama et al., 2006), men kan oppstå som en komplikasjon til systemiske luftembolier. Luftembolier forekommer i 0,5 % av undersøkelsene og behandles ved å legge pasienten i sideleie med venstre side opp slik at luften blir liggende i apex av venstre ventrikkel, samt gi pasienten 100 % oksygen (Mynarek & Bosse, 2016; Nakamura, Matsumoto, Inoue, Matsusue, & Fujii, 2021).
CT-veiledet biopsi utføres som regel av radiolog og det er viktig at pasienten er innforstått med risikoen for komplikasjoner før det henvises til biopsi.
Pleuravæskeanalyse
Hos pasienter med mistenkt lungekreft og pleuraeffusjon bør det utføres tapping av væske for diagnostikk. I utgangspunktet er pleuravæske hos pasient med lungekreft «malign inntil det motsatte er bevist».
Pleuratapping bør utføres ultralydveiledet. Et volum på 25-50 ml anbefales til cytologiske analyser inkludert celleblokk (Asciak et al., 2023). Volumet vil avhenge av tilgjengelig apparatur ved den lokale patologiavdeling. Diagnostisk sensitivitet er 74 % ved lungekreft og 45 % ved malignt mesoteliom. Ved residiv av pleuravæsken øker ny tapping sensitiviteten med 27 % og det anbefales derfor ny tapping ved negativt funn i første pleuratapping. Mutasjonsanalyse ved primært adenokarsinom kan bestemmes i 75-82 % av tilfellene. Faktorer som har betydning for det diagnostiske utbytte er histologisk undergruppe, kvalitet av prøven samt patologienhetens apparatur og ekspertise (Martinez-Zayas, Molina, & Ost, 2022).
Ved manglende diagnostisk resultat etter to separate pleuratappinger bør man vurdere annen utredningsmodalitet dersom det dreier seg om eksudat. Pleurabiopsi kan utføres UL eller CT veiledet med sensitivitet på 76 % og i siste instans torakoskopisk biopsi med sensitivitet > 90 %
Pleuraeffusjon hos en pasient med lungecancer er ikke ensbetydende med pleural spredning og kan være betinget av andre årsaker. Hvis der derimot påvises maligne celler ved pleuratapping har pas M+ sykdom og er ikke tilgjengelig for kurativ behandling.
Mediastinoskopi
I takt med økt bruk av EBUS og EUS som ledd i utredning av mediastinale lymfeknuter, har indikasjon for og betydning av mediastinoskopi minsket og utføres nå i liten grad.
Mediastinoskopi utføres ved torakskirurgiske avdelinger, under generell anestesi. Dette kan utføres enten som tradisjonell (TM) eller videoassistert cervikalt mediastinoskopi (VAM). Anbefaling er som minimum biopsi fra lymfeknute stasjon 4 R, 7 og 4 L, men proksimale lymfeknuter i stasjon 10 R og 10 L. kan også nåes (De Leyn et al., 2014).
Sensitiviteten og spesifisiteten ved VAM for lymfeknutespredning er henholdsvis 89 % og 100 % (Silvestri et al., 2013).
Komplikasjoner i relasjon til mediastinoskopi er blødning, stemmebåndsdysfunksjon, trakeal skade samt pneumotoraks (Lemaire et al., 2006).
I en nyere studie av pasienter med lungekreft, som utover EBUS fikk utført mediastinoskopi, så man marginal reduksjon (1 %) av uforutsett N2 lymfeknutespredning sammenliknet med de som kun fikk utført EBUS. Og dette på bekostning av forsinket operativ tumorreseksjon, økt morbiditet i relasjon til komplikasjoner ved mediastinoskopi (6 %), mortalitet (0,6 %) samt behov for gjentatt generell anestesi (Bousema et al., 2023). På denne bakgrunn foreslo tilhørende lederartikkel at EBUS nå er å anse som både førstevalg og godt nok alene for diagnostisering av spredning til mediastinale lymfeknuter ved utredning av lungekreft (Dunne et al., 2023).
Torakoskopi
Torakoskopi inndeles i medisinsk torakoskopi (MT) og videoassistert torakoskopi (VATS). Begge kan brukes i både diagnostisk og terapeutisk hensikt.
Indikasjonen for MT er utredning av uavklart pleuravæske, inkludert mistanke om malignitet. Metoden er vist å ha en diagnostisk sensitivitet på 95 % mot 75 % ved torakocentese alene (Avasarala, Lentz, & Maldonado, 2021). MT kan også brukes til å inspisere pleurahinnene og ta biopsier av pleura parietale. Prosedyren utføres under lokalanestesi og moderat sedasjon med enten et rigid eller semirigid torakoskop. MT krever trening og bør ikke utføres hvis torakocentese har gitt diagnosen.
VATS er et kirurgisk inngrep og utføres i generell anestesi. Indikasjoner i diagnostisk øyemed er biopsier av mediastinale lymfeknuter som ikke er tilgjengelig ved EBUS/EUS eller mediastinoskopi (lymfeknute stasjonene 3A, 5, 6, 8, 9), inspeksjon og biopsier fra pleura og innvendig brystvegg. Er også aktuell ved uavklart pleuravæske og for biopsi av pleura og uavklarte lungelesjoner. Videre kan metoden brukes i eksplorasjon for å se om det foreligger operabilitet, eksempelvis mediastinal invekst (T4) (Mehrotra, D'Cruz, & Arthur, 2023).
Lungefunksjonsundersøkelser
Spirometri og måling av gassdiffusjon inngår begge i utredning av all lungekreft. Dette fordi lungefunksjonen kan være påvirket av selve kreftsykdommen, pasienten kan ha annen lungesykdom, fordi resultatet kan få betydning for valg av behandling og/eller for å kunne følge eventuelle senere bivirkninger av behandlingen (medikamenter, stråle).
Spirometri er særlig viktig ved kurativ behandling hvor kirurgi er et alternativ. Det foreligger flere internasjonale retningslinjer som divergerer i sine anbefalinger (Ha, Mazzone, Ries, Malhotra, & Fuster, 2016; E. Lim et al., 2010; Matheos, Ram, & Canelli, 2020; Postmus et al., 2017; Salati & Brunelli, 2016). Feltet preges av gamle studier og mangel på randomiserte undersøkelser. Det er således ikke tatt høyde for at både operasjonsmetoder og postoperativ behandling har endret seg siste 20 årene. Retningslinjene baserer seg også delvis på eksperters mening om hva som er akseptabel risiko forbundet med kirurgi.
Hos pasienter hvor kirurgisk fjerning av lungevev er aktuelt er to spørsmål viktige:
- Tåler pasienten selve operasjonen (for eksempel «enlungeventilasjon»)?
- Vil pasienten ha nok lungevev igjen etter operasjonen til ikke å bli plaget av dyspnoe?
For både 1 og 2 gjelder at det ikke er satt en absolutt nedre grense for hva en pasient kan ha av lungefunksjon. Her vil annen komorbiditet (spesielt annen lungesykdom og hjertesykdom) samt pasientens stå-på-vilje telle inn. Samtidig er det viktig å informere pasienten grundig slik at det kan gjøres et realistisk samvalg av behandlingsmetode.
Prinsippene for vurdering av operabilitet hos pasienter uten annen alvorlig komorbiditet er skjematisk skissert i Figur 8 under (grensene er veiledende og ikke absolutte):
- Normal lungefunksjon (FEV1 og DLCO begge > 80 % av forventet): Ingen restriksjoner
- Er FEV1 og/eller DLCO <80 % av forventet eller den postoperative beregnede FEV1 og/eller DLCO < 60 % av forventet: utvid med anstrengelsestest. Her er flere valg: Kardiopulmonal belastningstest (CPET), trappetest (SCT), shuttle walk test (SWT) eller 6-minutters gangtest (6MWT).
- Hvis den postoperative beregnede FEV1 og/eller DLCO er < 30 % av forventet anbefales CPET.
- Hvis resultatet ved trappetest er minst fire etasjer (uten pauser), SWT > 400m eller 6MWT > 300-500 meter anses pasienten operabel.
- Hvis resultatet ved trappetest er lavere enn fire etasjer (uten pauser), SWT < 400m eller 6MWT < 500 meter anbefales CPET.
- Maksimalt oksygenopptak ved CPET:
- > 20 ml/kg/min (eller >75 % av forventet) - operasjon opp til og med pneumektomi kan utføres
- 10-20 ml/kg/min (eller 35-75 % av forventet) - individuell vurdering anbefales (annen sykdom, stå-på-vilje, størrelse på reseksjon).
- < 10ml/kg/min (eller <35 % av forventet) - operasjon frarådes.
Formler for beregning av postoperativ FEV1 og DLCO finnes i avsnitt "Formler for beregning av postoperativ FEV1, DLCO og VO2Max" i Vedlegg. Vær oppmerksom på at den faktiske lungefunksjonen ofte blir bedre enn beregnet i løpet av det første året etter operasjonen (Yokoba et al., 2018). Som en tommelfingerregel blir postoperativ lungefunksjon (minst) 85 % av den preoperative etter en singel lobektomi (Matsumoto et al., 2018).
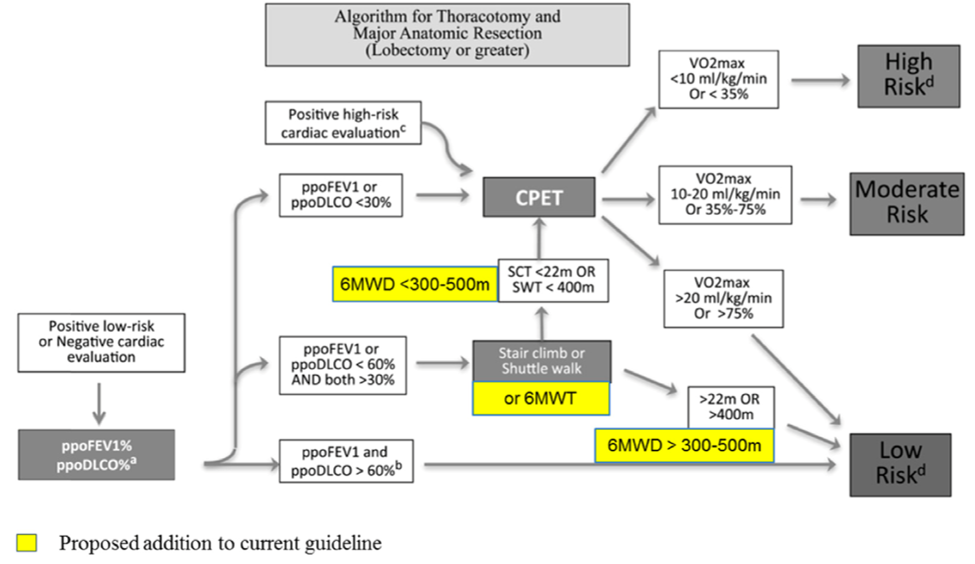
d Risiko angitt som lav (<1 % risiko for postoperativ mortalitet), moderat (risiko varier avhengig av anstrengelses toleranse, reseksjonens størrelse) eller høy (>10 % risiko for postoperativ mortalitet)
Gjengitt fra Ha et al., 2016. Med tillatelse fra J Thorac Oncol i 2024.
Hjertefunksjon
Dersom pasienten har symptomer og tegn på hjertesykdom og/eller tidligere kjent hjertesykdom, bør hen vurderes av kardiolog for avklaring om hjertesykdommen har konsekvenser for planlagt lungekreftbehandling, for eksempel kirurgi, strålebehandling eller kardiotoksiske medikamenter (Lyon et al., 2022; Smilowitz & Berger, 2020). Konklusjon og uttalelse fra kardiolog bør inneholde en risikoangivelse (lav eller høy) for hjertekomplikasjoner ledsaget av behandlingsforslag. Spesielt pasienter med koronarstent eller alder over 75 år er utsatt for hjertekomplikasjoner i forbindelse med kirurgi.