Prinsipper:
- Sentralisert behandling: Pasientene skal henvises til gynekologisk-onkologisk senter
- Primært kirurgi med en konservativ, individualisert tilnærming (Ansink & van der Velden, 2000; Beller et al., 2006; De Hullu et al., 2002; de Hullu et al., 2006; FIGO (International Federation of Gynecology and Obstetrics) 26th Annual Report on the Results of Treatment in Gynecological Cancer, 2006; Iversen et al., 1981; Jones & Rowan, 1994; Micheletti & Preti, 2014; Scheistrøen et al., 2002)
Behandling – vulva
Primærtumor
- Radikal eksisjon av primærtumor med histologisk fri rand. Utvidet eksisjon i form av skinning for å fjerne dVIN/LS primært anbefales. Behandling av patologisk positive margin er re-eksisjon.(Chan et al., 2007; Nooij et al., 2016; Woelber et al., 2016b; Woelber et al., 2011b).
- Radikal vulvektomi er sjelden indisert og innebærer at hele vulva fjernes. Musculus bulbocavernosus, musculus ischiocavernosus og musculus transversus perinei superficialis fjernes med fri rand.
- Ved affeksjon av eller kort avstand til meatus externum urethra, kan 1–2 cm av urethra reseseres. Ved behov for større reseksjon, konferer med urolog. Primær strålebehandling er et alternativ.
- Ved affeksjon av eller kort avstand (1–2 cm) til sphincter ani, vurderes anleggelse av stomi. Videre behandling kan være kirurgi eller strålebehandling.
- Ved større reseksjoner eller ved stort vevstap kan plastikkirurgisk assistanse ved rekonstruksjon være nødvendig (Aviki et al., 2015).
- Palliativ kirurgi med simpel tumor reseksjon eller palliativ strålebehandling kan vurderes ved kort levetid og komorbiditet.
- Lokalavansert tumor bør vurderes sammen med stråleteam for behandlingsvalg (operasjon, kjemoterapi og/eller stråling). (Ansink & van der Velden, 2000; De Hullu et al., 2002; de Hullu & van der Zee, 2006; Jones & Rowan, 1994).
- Ved resektable lesjoner vurderes ultraradikal kirurgi:
• Vulvectomi
• Lyskeglandeltoilette
• Plastikkirurgisk rekonstruksjon
• Delvis eller full bekkeneksentrasjon kan vurderes i enkelte tilfeller
• Krever team av gyn onkologi, gastro, urologi, og plastikk spes. kompetanse
- Ved resektable lesjoner vurderes ultraradikal kirurgi:
Kjemo/strålebehandling primært eller neoadjuvant er beskrevet, men ikke sammenlignet med kirurgi i randomiserte studier (Scheistrøen et al., 2002).
Inoperable tilfeller
Radikal radiokjemoterapi er førstevalg for inoperable tilfeller (Oonk et al., 2017). Ved St IVB sykdom kan det være aktuelt å gi kjemoterapi alene. Utilstrekkelig data for anbefaling av kjemoterapi regime. Aktuelle kurer: cisplatin/paclitaxel eller cisplatin/5-FU.
Radikal radiokjemoterapi ved lokoregional sykdom
Standard behandling av inoperable lokalavanserte vulva cancer er ekstern strålebehandling med kjemoterapi (Moore et al., 2012; Oonk et al., 2017; Rao et al., 2017).
Det fins ikke randomiserte studier på radikal radiokjemoterapi vs. strålebehandling alene ved vulvacancer. Men utfra studier på plateepitel karsinom i cervix og ØNH med konkomitant kjemoterapi, anbefales også konkomitant kjemoterapi ved strålebehandling ved vulvacancer. Ved definitiv radiokjemoterapi er strålebehandlingen den viktigste komponenten av behandlingen. En bør derfor avstå fra konkomitant kjemoterapi framfor å risikere å avbryte strålebehandlingen hos pasienter med redusert toleranse på grunn av nedsatt allmenntilstand eller komorbiditet.
Kjemoterapi gis i form av cisplatin 40 mg/m2 (maxdose 70 mg) en gang per uke, max 6 ukedoser. Ved nedsatt nyrefunksjon kan ukentlig karboplatin AUC2 brukes som alternativ.
Brakyterapi med interstitiell teknikk som boost mot tumor kan være aktuelt for enkeltpasienter (bl.a. Bartholini cancere). Disse pasientene skal henvises til Radiumhospitalet for vurdering.
Behandlingstid
Vi anbefaler å opprettholde planlagt behandlingsintensitet med 5 behandlinger per uke og unngå pauser i behandlingen. Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser. Ved behandlingspauser gjelder tilsvarende prioritering for kompensasjon som ved cervix, (se avsnitt "Behandlingstid" i kapittel Behandling i primærsituasjonen.
Forberedelser
Fiksering/pasientleie
Det anbefales at hvert stråleterapisenter etablerer standard pasientfiksering i ryggleie med støtte under knærne og bena fiksert. Det anbefales ikke å legge pasientene i frog-posisjon.
Tumor kan eventuelt markeres med blystreng. Ved vekst av tumor inn i vagina kan gullkorn satt inn ved kranielle begrensning hjelpe ved inntegning.
Ved bruk av bolus over vulva anbefales det å plassere bolusen under CT-undersøkelsen for bedre reproduserbarhet ved behandlingen. 5 mm bolustykkelse er som regel tilstrekkelig. Eventuell bolus for å oppnå dose til huden i lysker kan defineres i doseplanleggingssystemet.
Hvis det tas cone-beam CT (CBCT) ved behandling bør denne brukes til å kontrollere plasseringen av bolusen.
Bildeopptak for 3D planlegging
Doseplanleggingen baseres på en CT undersøkelse med intravenøs kontrast. Snitt-tykkelse bør maksimalt være 3mm. Drikkeprotokoll anbefales.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, samregistrerte T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. Hvis det foreligger en MR i behandlingsposisjon (flatt bord, fiksering), kan denne samregistreres med CT med matching på ben. 3D serie er en forutsetning for en god match. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel match ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 9:2012 Volum og doser i ekstern stråleterapi (Levernes, 2012).
Inntegning av risikoorganer
Ved bestråling av vulvacancer bør følgende risikoorgan tegnes inn:
Risikoorgan | Beskrivelse av inntegning |
|---|---|
AnalCanal | Hvis ønskelig |
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum | Rektum inkludert rektumveggen fra anorektal sfinkter til overgangen til sigmoideum. |
Bowel | Ytterkontur av tarmslyngene, inkludert mesenterium (ikke abdominalkavitet, store kar eller muskler) og sigmoideum. |
FemoralHeads | Hoftekulene |
CaudaEquina | Hvis ønskelig |
Urethra | Hvis relevant |
Inntegning av målvolumer ved primær strålebehandling av vulva
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks p benyttes som en indikasjon på målvolum knyttet til primærtumor, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er en nomenklatur som er i tråd med nasjonal anbefaling: Faglige anbefalinger for nomenklatur for volumer i stråleterapi (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
GTVp_MR: Primærtumor uten margin kan tegnes inn på T2‐vektet MR med støtte fra klinisk undersøkelse.
GVTp_PT: Primærtumor uten margin kan tegnes inn på FDG PET‐CT der denne er tatt i behandlingsposisjon.
GTVn_dose: Patologiske lymfeknuter uten margin tegnes inn på CT eventuelt på en samregistrert MR. Ved inntegning av flere GTVn skal disse nummereres og dose bør angis.
Patologiske lymfeknuter defineres i hovedregel ved hjelp av radiologi. European Society of Urogenital Radiology anbefaler at følgende retningslinjer benyttes (Balleyguier et al., 2011):
- FDG PET positiv
- Og/eller: kortakse større eller lik 1 cm på CT eller MR
- Og/eller: mindre lymfeknuter med patologisk morfologi på MR med en eller flere egenskaper:
- Uregelmessig avgrensning
- Høyt intensitetssignal
- Rund fasong
Dersom histologisk prøve av radiologiske usikre lymfeknuter er mulig, kan dette være aktuelt når diagnostikk har betydning for behandlingsvalg (f.eks primærbehandling med kirurgi vs. radiokjemoterapi).
Clinical Target Volume (CTV), Klinisk målvolum (Gaffney et el., 2016)
CTVp: GTVp_MR + 10mm og korrigeres for naturlige barrierer der det ikke er innvekst.
Avhengig av utbredelse må større marginer vurderes. Faktorer som har vist å gi økt risiko for residiv (Te Grootenhuis et al., 2018) og som kan være argument for større margin er
- dVIN og lichen sclerosus i reseksjonsrand
- Multifokalitet
- FIGO II og høyere
Det kan settes inn gullkorn for å markere øvre avgrensning i vagina.
CTVn: skal minimum inkludere hele lymfekuten på MR og CT. Ekstrakapsulær vekst må tas hensyn til. En typisk margin er 0‐3 mm fra GTVn bortsett fra mot sikre anatomiske barrierer.
CTVe:
- Hele vulva skal inkluderes
- Lymfeknuteregioner (bilateralt):
- Lymfeknutestasjoner i iliaca externa + iliaca interna + obturator + i lysken.
- Ved positive lymfeknuter i bekkenet utvides til aorta bifurkatur.
- Ved innvekst i analkanal/anale sfinkter inkluderes perirektale (mesorektum) samt presakrale lymfeknuter.
- Ved innvekst i anus/analkanal, blære eller rektum: GTV + 2 cm av anorectum/blære.
- Ved innvekst vaginalt: GTV + 3 cm proksimalt (vaginalt). Dersom usikker proksimal utbredelse eller ved LVSI, bør hele vagina inkluderes i CTV.
- Ved periuretrale lesjoner: GTV + 2 cm av uretra. Dersom utbredelse til midtre eller proksimale del av uretra bør hele uretra og blærehals inkluderes i CTV.
- Ved innvekst rundt klitoris: GTV + 2 cm og ligamentum suspensorium som strekker seg helt opp til os pubis
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur).
- CTVe tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Volumet skal ligge cirka 5 mm under ytterkonturen hvis ikke det er indikasjon for dosedekning i huden.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut ifra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Volum | Totaldose EQD2 (α/β =10) |
|---|---|
CTVe | 45 Gy |
CTVn_pelvis | 59 Gy |
CTVn_groin | 66 Gy |
CTVp | 66–69 Gy |
Det anbefales å gi den ønskede dosen til CTV- volumene med 28 fraksjoner, i alle fall ved totaldoser over 66 Gy, da det er lite erfaring med fraksjonsdoser høyere enn 2.4 Gy. Individuell vurdering av dosenivå ut fra størrelse og beliggenhet av patologiske lymfeknuter kan være fornuftig.
Volumnavn | Fraksjonsdose | Nominell totaldose | Totaldose EQD2 (α/β =10) |
|---|---|---|---|
CTVe_48 | 1.7 Gy | 47.6 Gy | 46.4 Gy |
CTVn_pelvis_59 | 2.1 Gy | 58.8 Gy | 59.3 Gy |
CTVn_groin_64 | 2.3 Gy | 64.4 Gy | 66.0 Gy |
CTVp_67 | 2.4 Gy | 67.2 Gy | 69.4 Gy |
Beregningsalgoritmer og energi
Her benyttes tilsvarende som for livmorhalskreft (se avsnitt "Beregningsalgoritmer og energi" i kapittel Behandling i primærsituasjonen.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) med simultanintegrert boost bør benyttes.
Normering
Ved kun ett dosenivå anbefales det å normere til median i PTV eller CTV.
Ved flere dosenivåer med simultanintegrert boost er en mulighet å normere til median i et volum som består av PTV/CTVe der PTV til høyere dosenivå er ekskludert.
En alternativ mulighet er å normere til D98 til CTV til det høyeste dosenivået.
Dosefordeling i CTVn
Det kan brukes en dosefordeling for lymfeknuteboost som tar hensyn til sannsynligheten for dosedekning (Pötter et al., 2018). Det vil si at det antas at CTVn oppholder seg mer i det sentrale området enn i kanten av PTVn. Som følge av dette er målet å oppnå en heterogen dose i PTVn med sentraldose høyere enn 100 % og dose i kanten til 90 %. Det er ønskelig å eskalere sentral del av GTVn til for eksempel D50 > 102 %, samtidig som øvre grense på 107 % respekteres.
Dosevolumkrav og ønsker til målvolumene
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
CTVe | D99.9 > 95 % | |
CTVn | D98 > 100 % | D50 > 102 % |
CTVp | D99.9 > 95 % | |
PTVe | D98 > 95 % DMaks < 107 % * |
|
PTVn | D98 > 90 % DMaks < 107 % * |
|
PTVp | D98 > 95 % DMaks < 107 % |
|
* Maksdosekravene gjelder hvis det ikke er målvolum som skal til høyere dose.
Toleransedoser for risikoorgan
Normalvevstoleranse handler ikke bare om dosenivåer, men ofte også om hvor stort volum som blir bestrålt til hvilken dose. Karakteristikken på denne dose-volum-sammenhengen varierer mellom ulike organer.
EMBRACE2 er en studie for livmorhals kreft der dosevolumkrav og ønsker for risikoorgan er angitt. Det anbefales å benytte en del av disse også ved vulva cancer. Erfaringsmessig kan ofte en del av disse dosevolumønskene oppfylles for vulva. Det et ikke alltid mulig å oppfylle ønskene, men parameterene kan likevel være nyttige ved optimalisering av doseplanen.
Organ | Dosevolum ønske |
|---|---|
Bowel | V40 Gy < 250 ccm V30 Gy < 500 ccm |
Bladder | V40 Gy < 60 % V30 Gy < 80 % |
Rectum | V40 Gy < 75 % V30 Gy < 95 % |
FemoralHead | DMaks < 50 Gy |
Body | DMaks < 107 % |
Når alle dosevolumkrav og ønsker ikke er mulig å oppfylle anbefales det å benytte følgende prioritering:
- PTV
- Rectum
- Bowel
- Bladder
- FemoralHead
Denne prioriteringen er generell, og bør vurderes for hver pasient.
Gjennomføring av behandlingen
Det er vanlig å posisjonere pasienten etter påtegninger/tatoveringer på hud og/eller ved hjelp av overflateskanningssystemer.
Det anbefales at det gjennomføres daglig bildematch på skjelettstrukturer og posisjoneringskorreksjon før behandling. Hvis det er mulighet for å korrigere bord for pitch, roll og rotasjon, gjøres dette.
Hvis det tas cone beam CT (CBCT), anbefales det å benytte denne til å kontrollere bolusplasseringen i de tilfellene bolus benyttes.
Ved endret anatomi i løpet av strålebehandlingen må replanlegging vurderes. Ødem i lyske er en vanlig årsak til endret anatomi for denne pasientgruppen.
Behandling – lymfeknuter
Hovedprinsipper
Inguinal lymfeknuteekstirpasjon er ikke indisert hvis stromal invasjon er ≤ 1 mm (Ansink & van der Velden, 2000; Chan et al., 2007; de Hullu et al., 2006; Iversen et al., 1981; Jones & Rowan, 1994; Micheletti & Preti, 2014; Pouwer et al., 2017; Scheistrøen et al., 2002; Woelber et al., 2011b).
- inguinofemoral lymfadenectomi gir mindre lyskeresidiv og bedre overlevelse enn primær strålebehandling (de Hullu & van der Zee, 2006; Micheletti et al., 2005; van der Velden et al., 2011; Woelber et al., 2011a).
- Patologiske lymfeknuter i bekken > 2 cm bør fjernes.
Ved forstørrede og cytologisk/patologisk bekreftet lymfeknutemetastase i lysker, er optimal behandling usikkert, men vi anbefaler inguinofemoral lymfadenectomi inntil videre kunnskap foreligger (Oonk et al., 2017).
- Radikal inguinofemoral lymfadenectomi gjøres ved å åpne femoralistriangelen og fjerne de overfladiske og dype inguinofemorale lymfeknutene.
- Lyskedren etter lymfadenectomi beholdes i minst 2 dager og fjernes når produksjon < 30 ml/døgn (senest etter 1 måned).
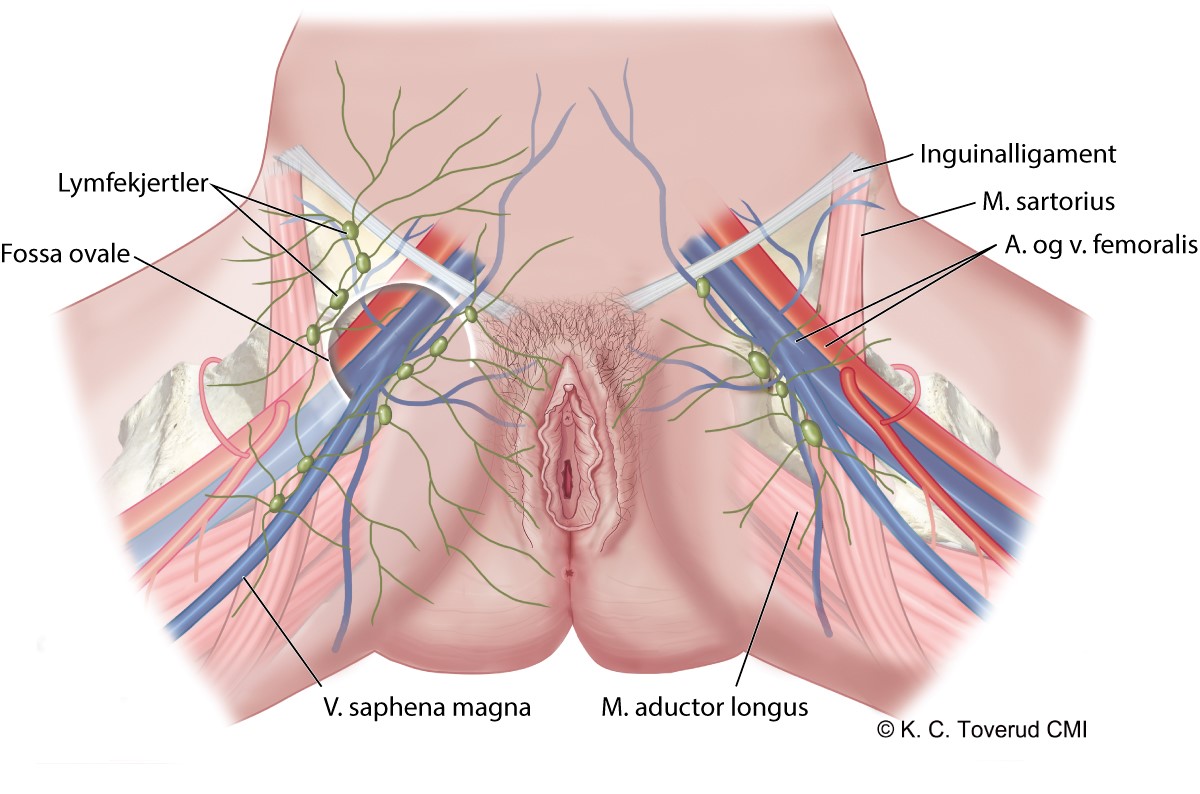
Sentinel node (SN)-vaktpostlymfeknute-teknikk
Bør kun brukes ved senter med kirurgisk erfaring og histopatologisk kompetanse.
Indikasjon: Unifokal tumor <4 cm og invasjon > 1 mm uten suspekte lymfeknuter (Ansink & van der Velden, 2000; Coleman et al., 2013; de Hullu & van der Zee, 2006; Hauspy et al., 2007; Lawrie et al., 2014; Levenback et al., 2001; Levenback et al., 2004; Levenback et al., 2012; Oonk et al., 2010; Pouwer et al., 2017; Robison et al., 2014; Stehman et al., 1992; Woelber et al., 2011b).
- SN ipsilateralt ved lateralt lokalisert tumor (>1 cm fra midtlinje).
- SN bilateralt ved midtlinje lokalisert tumor (≤ 1 cm fra midtlinje).
- Ved mislykkes SN prosedyre, bør bilateralt inguinofemoral lymfadenectomi utføres hvis tumor krysser midtlinje. Kontralateralt inguinofemoral lymfadenectomi kan unnlates hvis tumor ikke krysser midtlinje.
- Ved positiv SN > 2 mm bør ipsilateralt inguinofemoral lymfadenectomi utføres. Dersom negativ SN i kontralaterale lyske, kan inguinofemoral lymfadenectomi unnlates her. Teknisk utførelse:
- Pr i dag anvendes både radioaktivt Technetium99 og methylenblått intracutant rundt tumor.
- Lymfescintigrafi vurderes for å identifisere lokalisasjon og antall SN.
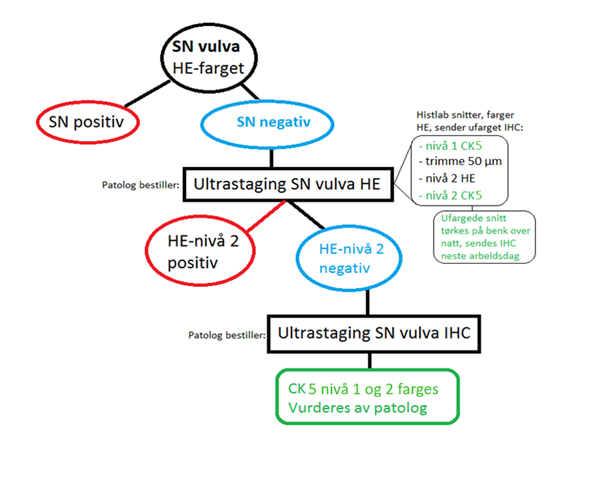
Histologisk us av SN: Følger de Europeiske retningslinjer for behandling av vulva cancer (Oonk et al., 2017).
- De uttatte lymfeknutene fikseres i formalin før makrobeskjæring (ikke frysesnitt).
- Ultrastaging med serieavsnitt på nivå på minst hver 200um. Hvis H&E negativ, bør immunohistokjemi undersøkelse utføres.
- SN måles og todeles i hilus, begge halvdeler legges i samme brikett. En brikett per SN. Ved store SN snittes det hver 3 mm på tvers av lymfeknuten gjennom hilus; alt innstøpes. Angi om snittflaten er metastasesuspekt
- Dersom det ikke påvises metastaser med lysmikroskopi bestilles dypere snitt og immunfarginger (se figur 8.7). Ved OUS benyttes CK 5 ved immunhistokjemisk us.
- Dersom man finner metastase skal største diameter måles, angi om det er perinodal infiltrasjon. Lymfadenectomi utføres.
- Prosedyre for histologisk undersøkelse av SN. (IHC = immunhistokjemi)
Adjuvant behandling
Adjuvant strålebehandling startes så fort som mulig, og helst innenfor 8-10 uker postoperativt. Det er usikkert om det har noen verdi, hvis det utsettes utover 12 uker postoperativt. En studie har vist at hvis tiden fra operasjonsdato til avsluttet adjuvant strålebehandling overstiger 105 dager faller median total overlevelse. (Oonk et al., 2023; Ashmore et al., 2021)
Indikasjoner
Ekstern strålebehandling mot lymfeknutestasjoner inguinalt og iliacalt evnt med kjemoterapi gis ved:(Ansink & van der Velden, 2000; Chan et al., 2007; de Hullu & van der Zee, 2006; Jones & Rowan, 1994; Levenback et al., 2004; Mahner et al., 2012; Oonk et al., 2010; Oonk et al., 2021; Robison et al., 2014; Scheistrøen et al., 2002; van der Velden et al., 2011; Woelber et al., 2011a; Woelber et al., 2011b):
- Positiv SN ≤ 2mm eller isolert tumor celler (ITC) etter SN ekstirpasjon
- Positive inguinofemorale lymfeknuter etter glandeltoalett:
- Ved 2 eller flere inguinofemorale lymfeknutemetastaser
- En lymfeknute med perinodal vekst
- Ved histologisk positive iliacale lymfeknuter.
Ekstern strålebehandling mot vulva gis ved:
- Positiv reseksjonskant på fiksert preparat der videre re-reseksjon ikke er mulig.
- Ved knapp rand med uttalt LVSI, perinevral infiltrasjon eller positive lymfeknuter kan postoperativ radiokjemoterapi mot vulva vurderes ut fra en individualisert vurdering (skal diskuteres multidisplinært). Det finnes ingen etablert grense for antall millimeter knapp rand i slike tilfeller.
Ved indikasjon for strålebehandling av lysker/bekken, men hvor det er operert fritt i vulva, skal vulva som hovedregel utelates fra strålefeltet (Gaffney et al., 2016). Tilleggsfaktorer som tumorstørrelse, multifokalitet og dVIN/lichen sclerosus i reseksjonskant vil favorisere tillegg av strålebehandling (Yap et al., 2016). Andre tilleggsfaktorer kan være diffus LVSI og/eller perinevral infiltrasjon. Nedsatt allmentilstand vil være argument for å avstå fra det. I praksis vil et lokalt residiv i vulva være vanskelig å rebestråle hvis begge lysker er bestrålt tidligere og dette må tas med i betraktningen. Man ender derfor som regel opp med en total vurdering av risikoforhold og fare for lokalt residiv målt opp mot toksisitet ved å inkludere vulva ved denne problemstillingen. For hvilke lymfeknutestasjoner som skal inkluderes se under CTVe under.
Konkomitant kjemoterapi, vanligvis ukentlig cisplatin 40 mg/m2, max 70 mg, vurderes for pasienter i god allmentilstand.
Behandlingstid og forberedelser inkludert fiksering/pasientleie og bildeoppdak for 3D planlegging er tilsvarende som ved Radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, samregistrerte T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. Hvis det foreligger en MR i behandlingsposisjon (flatt bord, fiksering), kan denne samregistreres med CT. 3D serie er en forutsetning for en god match. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel match ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i Strålevern Rapport 9:2012 Volum og doser i ekstern stråleterapi (Levernes, 2012).
Inntegning av risikoorganer
Tilsvarende som ved Radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Inntegning av målvolumer ved adjuvant strålebehandling av vulva
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks sb benyttes som en indikasjon på målvolum knyttet til tumortomt etter kirurgi, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er nomenklatur som er i tråd med nasjonal anbefaling: Faglige anbefalinger for nomenklatur for volumer i stråleterapi (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
Clinical Target Volume (CTV), Klinisk målvolum
CTVsb: Tumorseng ved ufri rand i vulva samt fjernet lymfeknute med perinodal vekst. Evt. serom i tilslutning skal som hovedregel inkluderes.
CTVe:
- Hele vulva skal inkluderes ved ufri rand. Ved indikasjon for lyskebestråling alene skal vulva som hovedregel ikke inkluderes.
- Lymfeknuteregioner som skal inkluderes er:
- Lymfeknutestasjoner i iliaca externa + iliaca interna + obturator + i lysken.
- Ved positive lymfeknuter i bekkenet utvides til aorta bifurkatur.
- Ved innvekst i analkanal/anale sfinkter inkluderes perirektale (mesorektum) samt presakrale lymfeknuter.
- Ved indikasjon for strålebehandling i én lyske og der det ikke er indikasjon for strålebehandling av vulva skal kontralateral lyske og bekken utelates (Jackson et al., 2006).
- Ved indikasjon for strålebehandling av vulva og én lyske bør som hovedregel også kontralateral lyske inkluderes i strålefeltet. Unntaket kan være ved strikt lateraliserte svulster (Oonk et al., 2017; Woelber et al., 2016a).
- Evt gjenværende patologiske lymfeknuter (CTVn) skal inkluderes.
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur).
- CTV tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Volumet skal ligge cirka 5 mm under ytterkonturen hvis ikke det er indikasjon for å dosedekning i huden.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut i fra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Volum | Totaldose EQD2 (α/β =10) |
|---|---|
CTVe | 45 Gy |
CTVsb | 59 Gy |
Det anbefales å gi den ønskede dosen til CTV- volumene med 25 fraksjoner.
CTVsb inkluderer tumortomt ved ufri rand.
Volum | Fraksjonsdose | Nominell totaldose | Totaldose EQD2 (α/β =10) |
|---|---|---|---|
CTVe_45 | 1.8 Gy | 45.0 Gy | 44.3 Gy |
CTVsb_58 | 2.3 Gy | 57.5 Gy | 58.9 Gy |
Beregningsalgoritmer og energi
Her benyttes tilsvarende som for livmorhalskreft.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) med simultanintegrert boost bør benyttes.
Normering
Det anbefales å normere til median i PTV eller CTV som skal til høyest dose.
Dosevolumkrav og ønsker til målvolumene
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
CTV | D99.9 > 95 % | |
PTV | V98 > 95 % DMaks < 107 % * |
|
* Maksdosekravene gjelder for det målvolumet som skal til høyeste dose.
Toleransedoser for risikoorgan
Tilsvarende som ved radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.
Gjennomføring av behandlingen
Tilsvarende som ved radikal radiokjemoterapi ved lokoregional sykdom, se avnitt "Radikal radiokjemoterapi ved lokoregional sykdom" ovenfor.