Kvinner med endometriecancer skal henvises til Gynekologisk avdeling i offentlig sykehus (lokalsykehus eller regionsykehus ut fra gjeldende funksjonsfordeling)(WHO Classification of Tumours Editorial Board, 2020) (Helsedirektoratet, 2017).
Primærbehandling
Primærbehandling av endometriecancer er tilpasset stadium og risiko for tilbakefall.
Inklusjon i studier skal alltid tilstrebes der det er mulig. Behandlingen bør sentraliseres til sykehus med gyn onkologisk avdeling og kompetanse på komplett kirurgisk staging.
Antatt stadium I/II
- Man anbefaler minimal invasiv kirurgi hos pasienter med endometriecancer (Galaal et al., 2012; Janda et al., 2017; Walker et al., 2009).
- Total laparoskopisk hysterektomi (TLH), bilateral salpingo-ooforektomi (BSO) og vaktpostlymfeknute
- Infrakolisk omentreseksjon anbefales hos kvinner med serøs endometriekarsinom, karsinosarkom og dediffensiert karsinom dersom det ikke foreligger kontraindikasjoner (Kaban et al., 2018).
- Onkologiske prinsipper skal følges. Preparater ekstirperes in toto, legges i pose på indikasjon. Minilaparotomi kan være aktuelt for uthenting av preparater.
- Vaginal hysterektomi med BSO kan vurderes hos pasienter hvor anbefalt prosedyre (over) ikke kan gjennomføres pga komorbiditet, og hos selekterte pasienter hvor kirurgisk staging ikke vil ha konsekvens for om pasienten skal motta adjuvant behandling eller ikke
- Man kan vurdere å la ovariene stå igjen hos pasienter < 45 år med grad 1/2 endometrioid adenocarcinom stadium 1A uten opplagt ovarial eller ekstrauterin sykdom. Tubene bør fjernes (Anggraeni et al., 2018; Concin et al., 2021; Kinjyo et al., 2015; Lau et al., 2015; Lyu et al., 2019).
- Man anbefaler ikke å la ovariene stå igjen hos pasienter med familiehistorie som gir økt risiko for ovarial cancer (BRCA mutasjon, Lynch syndrom etc.).
- Prøve til cytologi av bukskyllevæske kan tas ved operasjonens start) (Lee et al., 2016; Matsuo et al., 2018; Seagle et al., 2018). Det endrer ikke stadie.
- Radikal hysterektomi er ikke indisert ved stadium II, da det ikke endrer prognose. Frie marginer må likevel tilstrebes (Liu et al., 2019)
- Hos kvinner som ikke vil tåle adjuvant behandling, slik at staging ikke anses som relevant, eller hvor det kirurgiske inngrepet skal være så skånsomt som mulig, kan individuell vurdering mtp å avstå fra fjerning av lymfeknuter og omentektomi gjøres. Disse pasientene kan, etter å ha vært diskutert ved regionalt MDT møte, eventuelt opereres ved lokalsykehus med total laparoskopisk hysterektomi og bilateral salpingo-ooforektomi.
- Hos kvinner som ikke antas å tåle kirurgi, kan strålebehandling eller hormonbehandling vurderes.
- For fertilitetsbevarende behandling, se kapittel 1.8
Antatt stadium III/IV
Pasienter vurdert operable:
- Cytoreduktiv kirurgi med mål å fjerne all synlig sykdom, inkludert forstørrede glandler, dersom null restsykdom kan oppnås.
Pasienter vurdert inoperable primært:
Hos denne pasientgruppen kan man, etter diskusjon på MDT møte og med pasienten, tilby neoadjuvant kjemoterapi (se kap 1.8.5) i hovedsak i form av 3 kurer Karboplatin (AUC 5) + Paclitaxel (175 mg/m2) med påfølgende vurdering med billeddiagnostikk og diskusjon på MDT møte etter 3 kurer mtp forsinket primærkirurgi.
I enkelte tilfeller kan palliativ kirurgi utføres for å redusere plager og symptomer.
Palliativ strålebehandling er aktuelt ved blødning hos pasienter som ikke er kandidater for kirurgi.
Ved hormonreseptorpositive tumores kan hormonbehandling være aktuelt hos denne pasientgruppen.
Restaging
Restaging gjøres kun hos pasienter hvor det vil ha betydning mtp beslutning vedrørende administrasjon av adjuvant behandling, eller inklusjon i studier. Det skal foreligge CT thorax/abdomen/bekken. Restaging i form av lymfeknutetoilette (og omentektomi på indikasjon) med minimal invasiv kirurgi anbefales i de tilfeller hvor restaging er indisert.
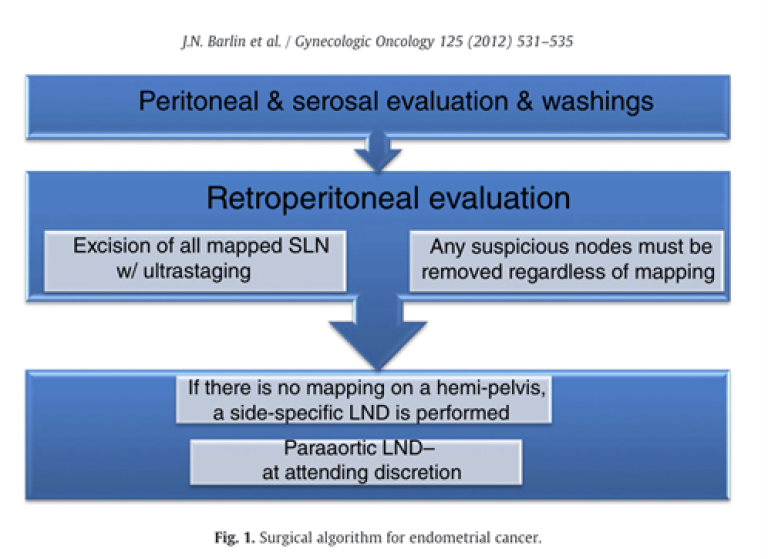
Vaktpostlymfeknute
Vaktpostlymfeknuteteknikk (Sentinel lymph node, SLN) har vist høy sensitivitet og spesifisitet mtp å detektere lymfeknutemetastaser hos kvinner med endometriecancer for alle risikogrupper (Ballester et al., 2011; Bogani et al., 2024; Concin et al., 2021; Cusimano et al., 2021; Hagen et al., 2016; Rossi et al., 2017) .Flere studier støtter gjennomførbarhet av vaktpostlymfeknute ved endometriekreft (Bogani et al., 2024; Concin et al., 2021) selv om det enda ikke foreligger data fra fase III randomiserte studier. Det er flere pågående studier, ALICE trial (Baiocchi et al., 2022), ENDO-3 (Obermair et al., 2021) og SELECT (Grassi et al., 2020) som vil undersøke vaktpostlymfeknute vs. lymfadenektomi og vs. ingen lymfeknutesampling. I en stor gruppe pasienter med lavrisiko endometriecancer og vaktpostlymfeknute (myometrieinfiltrasjon <50%, lavgradig) fant man lymfeknutemetastase i 6% av pasientene. Pasienter uten myometrieinfiltrasjon hadde ikke positive lymfeknuter (Kim et al., 2013) . I en multisenter observasjonsstudie fant en hos pasienter med endometroid histologi (tidlig stadie) (n=1359) 2.9% makrometastaser, 3.2% mikrometastaser og 5.3% ITC. Ingen makro/mikrometastaser og bare en ITC ble funnet hos 274 pasienter med lavgradig (G1-G 2) endometrioid endometrie cancer uten myometrie invasjon (De Vitis et al., 2024).
- Vaktpostlymfeknute kan erstatte lymfadenektomi
- Vaktpostlymfeknute bør utføres ved alle stadier av endometriekreft*
- Vaktpostlymfeknute kan unnlates ved G1/G2 endometroid endometriekreft uten myometriet infiltrasjon
- Eksisjon av forstørrede lymfeknuter (over 1 cm) som del av SLN algoritmen
*regionale prosedyrer kan foreligge
Vaktpostlymfeknute (SLN) prosedyre
Ved SLN prosedyre må en etablert SLN-algoritme følges. Se tabell under.
Indocyanine green (ICG) er gullstandard for SLN ved minimal invasiv kirurgi.
ICG 1.25 mg/ml, dvs 25 mg ICG pulver fortynnes i 20 ml sterilt vann. 2-4 ml ICG-blanding injiseres i cervix; 0.5–1 ml dypt i stroma og 0.5–1 ml submucosalt kl 3 og 9 før applikasjon av vaginal-rør. Sakte injeksjon. Reinjeksjon er mulig om sentinel lymph node ikke identifiseres.
Anestesipersonell bør informeres om at ICG injiseres da ICG inneholder jod og kan utløse en allergisk reaksjon selv om dette er sjeldent (<1%).
Ultrastaging er en del av SLN algoritmen og skal gjøres hos alle pasienter.
Adjuvant behandling
Anbefalinger for adjuvant behandling avhenger av prognostisk risikoprofil.
Adjuvant behandling gis til pasienter med (Jamieson et al., 2024; Johnson et al., 2011; Miller et al., 2020):
- Endometrioid adenocarsinom grad 3 og stadium IB
- Ikke-endometrioid histologi (serøse og klarcellet carsinom, carsinosarkomer, dedifferensierte karsinomer og udifferensierte karsinomer)
- Pasienter med > FIGO stadium I
- Dersom det foreligger flere risikofaktorer (eks ER og/eller PR negative, p53 aberrant, LVSI, ITC osv), som isolert sett ikke gir indikasjon for adjuvant behandling ut fra listen over, kan man gjøre en totalvurdering i hvert enkelt tilfelle.
Adjuvant behandling vil vanligvis være Karboplatin (AUC 5) og Paclitaxel (175 mg/m2). Dette gis hver 3. uke, totalt 6 sykluser. Det gjøres avsluttende evaluering etter 6 kurer. Hos noen kvinner er det indikasjon for tillegg av målrettet terapi:
Herceptin/Trastuzumab: Hos kvinner med serøs endometriecancer og overekspresjon av HER2/neu er det demonstrert at Herceptin/Trastuzumab i tillegg til Karboplatin og Paclitaxel gir økt overlevelse, både ved recidiv og ved metastatisk sykdom i første linje (stadium III og IV) (Fader et al., 2020). Godkjent som behandling i Beslutningforum 26.09.22 (nyemetoder.no).
Trastuzumab prioriteres foran Dostarlimab ved serøs endometriekreft med overekspresjon av HER2.
Dosering: 8 mg/kg iv eller sc 1. syklus, deretter 6 mg/kg iv eller sc hver 3. uke.
Behandlingstid: Inntil progresjon eller toksisitet.
Immunterapi med PD-1/PD-L1-hemmer (Dostarlimab/Durvalumab):
Det skilles mellom dMMR (mismatch repair deficient) og pMMR (mismatch repair proficient) tumor. Dostarlimab (Jemperli) eller Durvalumab (Imfinzi) i kombinasjon med Karboplatin og Paclitaksel er innført av Nye metoder som førstelinjebehandling av voksne pasienter med primær fremskreden eller tilbakevendende endometriekreft (EC) som er kandidater for systemisk behandling (Mirza et al., 2023; , Westin et al 2024), Nye metoder, 2022, 2024).
dMMR tumor: Dostarlimab eller Durvalumab kan tilbys i stadium III og IV, uavhengig av resttumor.
pMMR tumor: Dostarlimab kan tilbys i stadium IV, samt til stadium III ved resttumor, men effekd okumentasjonen er svakere enn for dMMR tumor.
Dosering Dostarlimab i kombinasjon med Karboplatin/Paclitaxel: Dostarlimab 500 mg iv hver 3. uke i 6 sykluser, etterfulgt av 1000 mg iv hver 6. uke som monoterapi. Behandlingstid: Inntil 3 år.
Dosering Durvalumab i kombinasjon med Karboplatin/Paclitaxel: Durvalumab 1120 iv mg hver 3. uke i 6 sykluser, etterfulgt av 1500 mg iv hver 4. uke som monoterapi. Behandlingstid: Inntil 3 år.
For pasienter med dMMR tumor er Durvalumab førstevalg (pga pris etter anbud fra Sykehusinnkjøp, gjeldende fra 01.01.25-01.09.26). Dostarlimab kan kontinueres hos pasienter som allerede er i pågående behandling.
For pasienter med pMMR tumor er kun Dostarlimab godkjent.
Adjuvant strålebehandling
Adjuvant strålebehandling brukes i andre land for å motvirke bekkenresidiv, men effekten på overlevelse er ikke godt dokumentert (Creutzberg et al., 2000; de Boer et al., 2019; Kong et al., 2012; Matei et al., 2019; Randall et al., 2019; Aalders et al., 1980). Det er signifikant toksisitet forbundet med strålebehandling. I Norge anbefales derfor ikke adjuvant strålebehandling som rutine.
Hos kvinner med stadium II, og knapp margin, kan adjuvant strålebehandling vurderes (Harkenrider et al., 2018).
Adjuvant behandling med progestagener har ikke dokumentert effekt (Martin-Hirsch et al., 2011; Vergote et al., 1989).
Ved funn av synkron endometrioid adenokarsinom grad 1 i både corpus og ovarium er det ikke indikasjon for adjuvant behandling.