Introduksjon
Standard behandling av lokalavansert cervixcancer er radikal radiokjemoterapi gitt som en kombinasjon av ekstern strålebehandling med konkomitant kjemoterapi og brakyterapi.
Behandlingstid
Den totale behandlingstiden, inkludert ekstern og brakyterapi, bør ikke overstige 7 uker/50 dager (Board of Faculty of Clinical Oncology, 2008; Girinsky et al., 1993; Perez et al., 1995, Royal College of Radiologist, 2019, Viswanathan et al., 2012). Studier indikerer at lokal kontroll og sykdomsfri overlevelse kompromitteres ved betydelig forlengelse utover dette (Perez et al., 1995; Pieterse et al., 2013; Viswanathan et al., 2012). Man er særlig bekymret for at akselerert repopulasjon kan redusere lokal kontroll ved for lange ukompenserte pauser (Fyles et al, 1992, Huang et al., 2012).
RCR (Royal College of Radiologist) Guidelines fra 2019 (Royal College of Radiologists, 2019) anbefaler at man om mulig unngår pauser i stråleterapi og at man følger Mackillop’s ASARA prinsipp om at pauser skal være «as short as reasonably achievable».
For pasienter med plateepitelcarcinom i cervix, vagina og vulva bør man unngå øket behandlingstid da det kan påvirke utfallet av behandlingen. For pasienter som bare har ekstern strålebehandling, ev i kombinasjon med kjemoterapi, bør ikke behandlingstiden økes med mer enn to dager ut over planlagt behandlingstid. Det må da has i mente at standard behandlingstid varierer med to dager avhengig av om behandlingsstart er på en mandag eller ikke.
Behandlingspauser
Dagens dokumentasjon foreligger på bakgrunn av behandling 5 dager per uke. Ved pauser i behandlingen (maskinstans, helligdager o.l.) bør det ved kurativ intensjon vurderes kompensasjons-behandlinger som hindrer at total behandlingstid overstiger 50 dager (Fyles et al., 1992; Mazeron et al., 2015; Perez et al., 1995; Tanderup et al., 2016). Selv om eksakt antall behandlingsfrie dager ikke spesifiseres i internasjonale studier, er det dokumentasjon som taler for behandlingspauser øker risiko for manglende sykdomskontroll. Det er derfor ønskelig med maksimalt 3 påfølgende dager uten behandling i perioden hvor det gis ekstern strålebehandling (Bese, Hendry, & Jeremic, 2007).
RCR (Royal Collage of Radiologist) Guidelines fra 2019 (Royal Collage of Radiologist, 2019) skisserer mulige kompensasjonsløsninger i prioritert rekkefølge:
- Opprettholde total behandlingstid, totaldose og dose pr fraksjon ved å:
- Behandle i helg eller på annen helligdag
- Gi 2 fraksjoner på samme dag med minst 6 timers mellomrom (fortrinnsvis rett før helgefri)
- Det skal ikke gis mer enn 6 fraksjoner per 7 påfølgende dager.
- Opprettholde total behandlingstid med økt dose per fraksjon
- Her må det velges om det skal gis ekvivalente doser med tanke på tumoreffekt eller med tanke på sene strålereaksjoner
- Akseptere økning av total behandlingstid og gi ekstra fraksjoner
- Her reduseres gjerne den terapeutiske bredden med følger både for tumorkontroll og forekomst av sene strålereaksjoner
Det må has i mente at en for aggressiv kompensasjon, vil gi uker med høy dose som, særlig ved konkomitant kjemoterapi, kan øke forekomst av akutte strålereaksjoner (Erridge et al., 2002).
Ekstern strålebehandling
Forberedelser
Fiksering/pasientleie
Det anbefales at hvert stråleterapisenter etablerer standard pasientfiksering i ryggleie. Spesielt fokus på reproduserbarhet av svai i ryggen da det kan ha stor betydning for nødvendige marginer spesielt ved paraaortal bestråling.
Bildeopptak for 3D-planlegging
Doseplanleggingen baseres på en CT undersøkelse med intravenøs kontrast. Snitt-tykkelse bør maksimalt være 3 mm. Det anbefales å benytte en drikkeprotokoll som gir komfortabel fylt blære. Målet med dette er å ha så lik blærefylling som mulig ved planlegging og behandling og å redusere dosen til blære og/eller tarm (Buchali et al., 1999). Rektum og sigmoid bør være så tom som mulig.
Inntegning av volumer
Inntegning av volumer utføres på bakgrunn av planleggings CT, T2-vektede MR bilder, eventuelt PET-CT og funn ved gynekologisk undersøkelse. MR, axial 3D T2W, i behandlingsposisjon (flatt bord, fiksering) anbefales for god samregistrering med CT’en.. Hvis det ikke foreligger MR med flatt bord/fiksering og en akseptabel samregistrering ikke oppnås, må samregistreringen gjøres på bløtvev for veiledning ved inntegning av tumor og cervix og eventuelt på bein ved inntegning av lymfeknuter.
Volumdefinisjoner i dette dokumentet bygger på retningslinjer gitt i StrålevernRapport 2012:09 (Levernes, 2012).
Inntegning av risikoorganer
Ved bestråling av cervixcancer bør følgende risikoorgan tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum | Rektum inkludert rektumveggen fra anorektal sfinkter til overgangen til sigmoideum. |
Sigmoid | Sigmoideum fra overgangen fra rektum til venstre fossa iliaca. Kan eventuelt tegnes inn som en del av Bowel. |
Bowel | Ytterkontur av tarmslyngene, inkludert mesenterium (ikke abdominalkavitet, store kar eller muskler). Kranielle begrensning: til og med L1 ved paraortal bestråling, L4 ved bekkenbestråling, blære, rectum og (sigmoid) skal ikke inkluderes. |
FemoralHeads | Hoftekulene. |
Kidneys | Ved bestråling av paraaortal regionen: hele nyrene, nyrebekkenet skal ikke tas med. |
Kidneys_PRV | Hvis ønskelig: Nyrene med PRV-margin i cranio/caudal retning for å ta høyde for nyrenes mulige bevegelse under strålebehandling. |
SpinalCord | Ved bestråling av paraaortal region: medulla fra toppen av nyrene og til cauda equina (mellom L2 og L3). |
Duodenum | Hvis ønskelig ved bestråling av paraaortal region over L1: Hele tolvfingertarmen. |
CaudaEquina | Hvis ønskelig ved lymfeknuteboost |
Inntegning av målvolumer
I nomenklaturen som benyttes for målvolumene i dette dokumentet, vil indeks p benyttes som en indikasjon på målvolum knyttet til tumor, n benyttes som en indikasjon på målvolum knyttet til lymfeknuter (nodes), og e benyttes som en indikasjon på målvolum hvor det ikke er påvist tumor, det vil si områder som skal ha elektiv bestråling. Dette er en nomenklatur som er i tråd med nasjonal anbefaling (Levernes, 2019).
Gross Tumor Volume (GTV), Tumorvolum
GTVp_MR: Primærtumor uten margin tegnes inn på T2‐vektet MR med støtte fra klinisk undersøkelse.
GVTp_PT: Primærtumor uten margin på FDG PET‐CT kan tegnes der denne er tatt i behandlingsposisjon.
GTVn#_dose:Patologiske lymfeknuter uten margin tegnes inn på CT eventuelt på en samregistrert MR. Ved inntegning av flere GTVn skal disse nummereres og dose bør angis, for eksempel GTVn1_55.
Patologiske lymfeknuter defineres i hovedregel ved hjelp av radiologi. European Society of Urogenital Radiology anbefaler at følgende retningslinjer benyttes (Balleyguier et al., 2011):
- FDG PET positiv
- Og/eller: kortakse større eller lik 1 cm på CT eller MR
- Og/eller: mindre lymfeknuter med patologisk morfologi på MR med en eller flere egenskaper:
- Uregelmessig avgrensning
- Høyt intensitetssignal
- Rund fasong
Dersom histologisk prøve av radiologiske usikre lymfeknuter er mulig, kan dette være aktuelt når diagnostikk har betydning for behandlingsvalg (f.eks primærbehandling med kirurgi vs. radiokjemoterapi eller om det foreligger indikasjon for paraaortal bestråling).
Clinical Target Volume (CTV), Klinisk målvolum
CTVp_HR: GTVp_MR + resterende del av cervix
CTVp_LR: Skal inkludere:
- CTVp_HR
- Parametriene på begge sider
- Hele uterus
- Ikke involvert vagina med 20 mm margin målt fra kaudale begrensning av CTVp_HR langs vaginal aksen (starter ikke i fornix).
- CTVp_HR med en 5 mm margin anteriort og posteriort mot blære og rektum (ikke inn i blære og rektum hvis det ikke er innvekst).
- Hvis det er innvekst i bekkenveggen, sakrouterine ligamenter, mesorektum eller andre involverte strukturer, vil det ofte være nødvendig å legge til en ekstra margin rundt CTVp_HR inn i disse strukturene.
CTVn: CTVn skal minimum inkludere hele lymfekuten på MR og CT. Ekstrakapsulær vekst må tas hensyn til. En typisk margin er 0–3 mm fra GTVn bortsett fra mot sikre anatomiske barrierer.
CTVe: Lymfeknuteregioner som skal inkluderes i CTVe er avhengig av risiko for spredning og er spesifisert i forhold til de ulike risikogruppene (lav, intermediær og høy) (Keenan et al., 2018; Lim et al., 2011; Taylor et al., 2007; Toita et al., 2011).
- Lymfeknuteregioner inkludert blodårer med omtrent 7 mm perivaskulært vev.
- Patologiske lymfeknuter (CTVn) skal inkluderes.
- CTV skal ikke tegnes inn i naturlige barrierer (bein/muskulatur/tarm).
- CTV tegnes i noen områder inn i tarm utfra individuelle vurderinger.
- Ovarier kan vurderes inkludert for eksempel ved utbredt affeksjon av uterus eller ligamentum latum infiltrasjon.
- Dersom patologiske lymfeknuter i mesorectum eller innvekst i rectum, bør hele mesorectum inkluderes.
EMBRACEII appendix 5: EBRT contouring atlas
Paraaortal inntegningsatlas (Keenan et al., 2018)
Risikogruppe | Definisjon | Lymfeknuteregioner inkludert i CTVe |
|---|---|---|
Lav risiko | Tumorstørrelse ≤4 cm og FIGO 1A/1B/IIA1 og N0 og plateepitel karsinom og ingen infiltrasjon i uterus | «Lille bekken»:
|
Intermediær risiko | Ikke «Lav risiko» Ikke «Høy risiko» | «Store bekken»:
|
Høy risiko | ≥ 1 patologisk lymfeknute i iliaca communis regionen eller høyere eller ≥ 3 patologiske lymfeknuter | «Store bekken + paraaortal»:
|
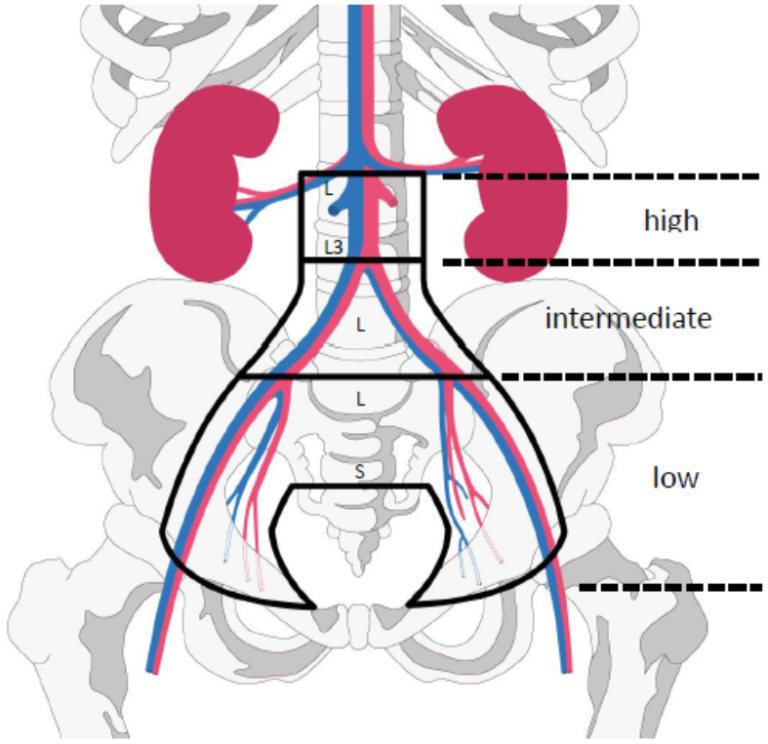
Marginer og marginrelaterte volumer
For å sikre rekvirert dose til CTV må det i tillegg til tumorutbredelse tas med marginer for ulike usikkerheter og variasjoner. ITV tar hensyn til usikkerhet og variasjon i størrelse, form og posisjon på CTV i pasienten. I tillegg inngår variasjon i ulike legers inntegning av målvolum. PTV er et geometrisk volum som skal sikre at rekvirert dose med akseptabel sannsynlighet blir gitt til alle deler av CTV når det tas hensyn til alle geometriske usikkerheter og variasjoner av pasient og utstyr (Levernes, 2012).
Internal Target Volume (ITV)
Margin mellom CTV og ITV: Intern bevegelse av cervix og uterus kan være store.
Det anbefales å bruke individualiserte ITV marginer.
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Følgende marginer kan benyttes som et utgangspunkt:
ITVp marginer for CTVp:
- 10 mm anterior/posterior
- 10 mm superior/inferior
- 5 mm lateralt
Individuell vurdering av marginene:
Diagnostiske bilder og doseplan CT kan gi informasjon om anatomiske forhold av betydning for doseplanlegging hos den enkelte pasient. MR eller CT med ulik blære/rektum fylling i forhold til planleggings CT’en vil for eksempel kunne bidra til å definere individualiserte ITV marginer. Ved daglig adaptiv behandling kan ITV-marginene reduseres. Hvis bildene er tatt i behandlingsposisjon vil de kunne samregistreres og dermed gi mer eksakt informasjon.
ITVp_45:
- Ikke inn i naturlig barrierer (bein/muskulatur).
- Det skal ikke legges til ekstra marginer caudalt i vagina.
- Ved tumorinfiltrasjon i den øvre delen av corpus uteri bør det i legges til en ekstra 5 mm margin utenfor livmor i alle retninger.
For lymfeknutestasjoner anses den interne bevegelsen å være ubetydelig og dermed vil ITV være lik CTV for CTVn og CTVe.
Planning Target Volume (PTV), Planleggingsvolum
Hver enkelt avdeling må vurdere sine PTV marginer ut i fra sitt eget behandlingsopplegg og rutiner for posisjonskontroll av behandlingen.
Fraksjonering
Ved radikal radiokjemoterapi av cervixcancer gis en kombinasjon av ekstern strålebehandling og brakyterapi. Det er derfor viktig å ta hensyn til bidraget fra begge disse behandlingsmodalitetene når dosen beregnes. For å kunne summere dosebidragene må dosen angis i 2 Gy’s ekvivalent dose, som beregnes ved hjelp av α/β –formelverket (Joiner et al., 2019). Det er benyttet α/β=3 for sentreagerende (normalvev) vev og α/β=10 for tumor.
| Fraksjonsdose | Totaldose | EQD2 (α/β =10) |
|---|---|---|---|
CTVp | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVe | 1.8 Gy | 45 Gy | 44.3 Gy |
CTVn i bekkenet | 2.2 Gy | 55 Gy | 56 Gy |
CTVn utenfor bekkenet | 2.3 Gy | 57.5 Gy | 59 Gy |
Det anbefales å benytte simultanintegrert boost (SIB) til lymfeknutemetastaser.
For lymfeknuter i bekkenet som antas å få lite dosebidrag fra braky, kan det vurderes å øke fraksjonsdosen til 2.3 Gy.
Den ekstra dosen til lymfeknutene kan alternativt gis som en sekvensiell boost.
Bakgrunn for doser til CTVn
Anbefalte doser til CTVn er mellom 55–65 Gy: Ifølge Mohamed SM (Mohamed et al., 2015) kan den forventede dosen fra brakyterapi bli tatt hensyn til ved at det anslås 3–4 Gy (EQD2) i lille bekken (iliaca externa/interna og obturator lymfeknuter), og neglisjerbar dose utenfor bekkenet (iliaca communis, paraaortale og inguinale lymfeknuter).
Med denne forutsetningen oppnås rundt 60 Gy til lymfeknuter i bekkenet ved å gi 56 Gy (EQD2) ved ekstern stråleterapi samt at de mottar 3–4 Gy (EQD2) ved brakyterapi.
Strålebehandlingsteknikker
Intensitetsmodulert strålebehandling (IMRT) eller intensitetsmodulert buebehandling (VMAT) anbefales for å redusere dosen til risikoorganer (Chopra et al., 2021; D'Souza et al., 2012; Gandhi et al., 2013; Klopp et al., 2018; Yeung et al., 2020).
Beregningsalgoritmer og energi
Det er anbefalt å bruke algoritmer som vil gi pålitelige beregninger også ved betydelige inhomogeniteter for eksempel: «Monte Carlo», «Acuros XB», «Collapsed Cone» eller «AAA»
Ved bruk av høye energier vil nøytrondosen øke, derfor er lavere energier (6 MV, 10 MV) å foretrekke.
Normering
Ved ett dosenivå (uten lymfeknuteboost) anbefales det å normere til median i ITV_45 (Alternativt PTV_45).
Ved flere dosenivåer og simultanintegrert boost er en mulighet å normere til median i et volum som består av ITV_45 der alle PTVn er ekskludert. (Alternativt PTV_45 ekskludert PTVn).
En alternativ mulighet er å normere til D98 til CTVn for det høyeste dosenivået.
DMin | Dosen til 99.9 % av volumet |
D98 | Dosen til 98 % av volumet |
Dvolum | Dosen til angitt volum |
Vdose | Volumet som mottar angitt dose |
| Dmaks | Punktdosemaks |
Volum | Dosevolum krav | Dosevolum ønske |
|---|---|---|
ITV_45 | DMin >95 % (42.8 Gy) | DMaks < 107 % (48.2 Gy) |
PTV_45 | D98 % > 95 % (42.8 Gy)* DMaks <107 % (48.2 Gy)** |
|
CTVn | D98 > 100 % av rekvirert dose | D50 > 102 % av rekvirert dose*** |
PTVn | D98 > 90 % av rekvirert dose DMaks < 107 % av rekvirert dose | |
xCTVp_HR+10 |
| DMaks < 103 % (46.4 Gy) |
* EMBRACE 2 har en dosevolumkrav D95% > 95% for å spare risikoorgan.
** Maksdosekravene til ITV_45 og PTV_45 gjelder i tilfeller uten lymfeknuter som skal boostes. Ved lymfeknuteboost anbefales å lage et volum det PTVn ekskluderes og se på maksodsene til disse volumene.
*** For større lymfeknuter. Vanskelig å oppnå på små lymfeknuter.
Dosefordeling i CTVn
Det brukes en dosefordeling for lymfeknuteboost som tar hensyn til sannsynligheten for dosedekning. Det vil si at det antas at CTVn oppholder seg mer i det sentrale området enn i kanten av PTVn. Som følge av dette er målet å oppnå en heterogen dose i PTVn med sentraldose høyere enn 100 % og dose i kanten til 90 %. Hvis det er store lymfeknuter, er det mulig å eskalere sentral del av GTVn til for eksempel D50 > 102 %, samtidig som øvre grense på 107 % respekteres (Ramlov et al., 2017a).
Dosefordeling i brakyområdet
Det er viktig å unngå høye doser til risikoorganer som får dosebidrag fra brakyterapi. Det vil si de risikoorganene som ligger nært CTVp_HR (blære, rektum, sigmoid og tynntarm). For å unngå høye doser i dette området genereres det en hjelpekontur (xCTVp_HR_10) som er CTVp_HR med 10 mm margin. Dosen innen denne hjelpekonturen anbefales å være mindre enn 103 % av 45 Gy for å unngå varme områder i risikoorganene som vil få vesentlig bidrag fra braky.
Toleransedoser
Normalvevstoleranse handler ikke bare om dosenivåer, men ofte også om hvor stort volum som blir bestrålt til hvilken dose. (Dawson et al., 2010; Jensen et al., 2021; Spampinato et al., 2021a, 2021b; Spampinato et al., 2022; Westerveld et al., 2022). Karakteristikken på denne dose-volum-sammenhengen varierer mellom ulike organer.
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < 105 % (47.3 Gy) | V40 Gy < 250cm3* V30 Gy < 500cm3* |
Sigmoid | DMaks < 105 % (47.3 Gy) |
|
Bladder | DMaks < 105 % (47.3 Gy) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < 105 % (47.3 Gy) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 107 % (48.2 Gy) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Organ | Dosevolum krav | Dosevolum ønske |
|---|---|---|
Bowel | DMaks < rekvirert dose til PTVn | Bekkenbestråling: V40 Gy < 250 cm3 |
| DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | Paraortal bestråling: V40 Gy < 300 cm3 |
Sigmoid | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder 10–15 mm fra PTVn) |
|
Bladder | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 60 %* V30 Gy < 80 %* |
Rectum | DMaks < rekvirert dose til PTVn DMaks < 47.3 Gy (i områder utenfor 10–15 mm fra PTVn) | V40 Gy < 75 %* V30 Gy < 95 %* |
SpinalCord | DMaks < 48 Gy |
|
FemoralHead | DMaks < 50 Gy |
|
Kidney | DMean < 15 Gy | DMean < 10 Gy |
Body | DMaks < 48.2 Gy (i områder utenfor 10–15 mm fra PTVn) |
|
Duodenum | V55 Gy < 15 cm3 |
|
Gjennomføring av behandlingen
Det er vanlig å posisjonere pasienten etter påtegninger/tatoveringer på hud og/eller ved hjelp av overflateskanningssystemer.
Det anbefales at det gjennomføres daglig bildematch på skjelettstrukturer og posisjoneringskorreksjon før behandling. Hvis det er mulighet for å korrigere bord for pitch, roll og rotasjon, gjøres dette.
Ved paraaortal bestråling vil en liten rotasjon i bekkenet kan ha stor påvirkning på posisjonen til lymfeknutene. Det anbefales derfor ikke å korrigere for pitch i disse tilfellene.
Ved daglig matching på skjelettstrukturer i bekkenet inkludert bordkorreksjon er det mulig å redusere PTV-marginene fra 10 til 5 mm for elektivt lymfeknutevolum uten å gå på kompromiss med målvolumdekningen (Laursen et al., 2012) .
Ved cone beam CT (CBCT), er det mulig å se om den daglige uterus posisjonen er signifikant forskjellig fra forventet, og denne kunnskapen kan brukes til å avgjøre om det er behov for en ny behandlingsplan.
Hvis CBCT’en viser at signifikante deler av CTV’ene er gjentagende utenfor 95 % isodosevolumet anbefales det å:
- Vurdere om det er tilstrekkelig blærefylning
- Ta ny planleggings CT for å replanlegge
- Redefinere ITV og ta hensyn til informasjonen en får ut fra CBCT’ene
- Justere PTV marginene
- Det er aksept for 10 % underdosering av ikke‐involvert fundus uteri så lenge bidraget fra ekstern strålebehandling er minimum 40 Gy (EQD2)
Brakyterapi
Boost til tumor i form av brakyterapi er nødvendig for å oppnå høy nok stråledose for kurasjon (Gill et al., 2014). Behandlingen gis gjerne mot slutten av eller etter den eksterne stråleterapien for å oppnå størst mulig tumorskrumpning. De siste 10–15 årene har brakyterapi basert på volumetrisk/3D avbildning blitt tatt i bruk. Pasienten får da en individuell tilpasset behandling ved hver fraksjon, såkalt adaptiv billedveiledet brakyterapi (IGABT). Internasjonale publikasjoner har beskrevet økt lokal kontroll, bedret overlevelse og redusert forekomst av alvorlige bivirkninger hos pasienter behandlet med IGABT sammenliknet med historiske kontroller behandlet med konvensjonell, punktdosert brakyterapi (Charra-Brunaud et al., 2012; Fokdal et al., 2018; Jensen et al., 2018; Lindegaard et al., 2013; Rijkmans et al., 2014; Sturdza et al., 2016).
Utstyr
Gynekologisk brakyterapi i Norge gis med med etterladningsapparater, og det benyttes høydoserate (HDR). Det gis behandling med ringapplikator og intrauterinsonde, eventuelt benyttes også interstitielle nåler.
Gynekologisk undersøkelse
Før innleggelse av applikator, skal tumorutbredelse og lokale forhold i vagina/cervix/uterus som har betydning for valg av applikator og teknikk bedømmes klinisk ved gynekologisk undersøkelse under anestesi. Transrektal UL kan være til hjelp i denne vurderingen.
Bildeopptak for 3D-planlegging
Det anbefales at det tas MR eller CT med applikator i pasient før hver fraksjon (Cibula et al., 2018b; The International Commission on Radiation Units & Measurements (ICRU) et al., 2016).
MR anbefales framfor CT på grunn av bedre evne til å skille tumor fra øvrig bløtvev i og rundt cervix..
CT/MR tas med liten snitttykkelse for å få en mest mulig riktig avbildning av applikatorene (maksimalt 3 mm). Ved MR-opptak vil T2 vektede bilder og 3D-sekvenser gi den beste informasjonen.
Blærevolumet skal være så likt som mulig på bildeopptaket og under behandling.
Inntegning av volumer og definering av punkter
Inntegning av volumer utføres på bakgrunn av planleggings MR eller CT (fortrinnsvis med samregistrerte T2-vektede MR bilder) og gynekologisk undersøkelse.
Inntegning av risikoorganer
Risikoorganene skal tegnes inn på planleggingsbildene for aktuell fraksjon.
Følgende risikoorgan bør tegnes inn.
Risikoorgan | Beskrivelse av inntegning |
|---|---|
Bladder | Hele blæren inkludert blæreveggen og blærehalsen. |
Rectum* | Rektum inkludert rektumveggen fra innenfor relevant avstand |
Sigmoid* | Sigmoid fra overgangen fra rektum. |
Bowel | Ytterkontur av tarmslyngene som er posisjonert innenfor relevant avstand |
* Hvis overgangen mellom rektum og sigmoideum kommer i nærheten av applikatoren er det anbefalt å flytte overgangen opp eller ned slik at maksimal D2ccm kommer i ett organ. Dette området bør ligge i samme organ ved alle fraksjoner.
Inntegning av målvolumer
Det er anbefalt at målvolumer tegnes inn i henhold til GEC ESTRO anbefalingene (Haie-Meder et al., 2005).
Følgende målvolum bør tegnes inn:
Målvolum | Beskrivelse av inntegning |
|---|---|
GTV | Synlig gjenværende tumor på MR. |
CTV_HR | Adaptivt høyrisiko klinisk målvolum inkluderer resttumor inklusiv usikre områder i parametriene (på MR) samt resterende del av cervix. |
Følgende punkter defineres:
Punkter | Beskrivelse av plassering |
|---|---|
ICRU recto‐vaginal | 5 mm posterior for vaginalveggen. (Skal defineres). |
ICRU bladder | Den mest posteriore posisjonen i det snittet hvor kateterballongen har størst utstrekning (valgfritt). |
Vaginal point | 5 mm fra vaginalapplikatorens overflate i sin og dxt (valgfritt). |
A1 og A2 | 20 mm kranielt for vaginalapplikator langs uterinsonden og 20 mm lateralt for uterinsonden (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). |
Strålebehandlingsteknikker ved brakyterapi
Det anbefales å benytte seg av applikatorbibliotek for å rekonstruere applikator hvis det er tilgjengelig.
Standard dosefordeling basert på dose til punkt A vil ofte ikke gi en optimal behandling, verken med hensyn på dekning av målvolum eller dose til kritiske organ. Det anbefales likevel å ta utgangpunkt i en standardplan (The International Commission on Radiation Units & Measurements (ICRU) et al., 2016). Hvis det ikke tas utgangspunkt i en standardplan, er det ekstra viktig å se på hvor den høye dosen blir avsatt etter optimalisering.
Interstitielle nåler
I en del situasjoner vil det ikke være mulig å oppnå ønsket dose til tumor og/eller akseptabel dose til risikoorganer kun ved bruk av intrakavitære applikatorer. Det anbefales da å benytte interstitielle nåler/katetre. I RetroEMBRACE studien fant man at brakyterapi med intrakavitær/insterstitiell teknikk til store svulster ga signifikant bedret lokal kontroll uten økt morbiditet (Fokdal et al., 2016).
Interstitielle katetre kan plasseres ved hjelp av definerte posisjoner i utstyret eller direkte i tumorvevet der standardposisjonene ikke gir et tilfredsstillende resultat. Interstitielle kateterposisjoner må rekonstrueres manuelt. Generelt anbefales det ikke å lade nålene mer enn 20–30 % i forhold til liggetiden i de intrakavitære applikatorene. Hvis nålene skal lades mer, må posisjonen til nålen og den aktuelle kildeposisjonen vurderes. Den endelige planen må vurderes nøye med hensyn på dosefordeling og lokalisasjon av de kildeposisjonene som benyttes (Dimopoulos et al., 2006; Fokdal et al., 2013).
Det anbefales at avdelinger uten erfaring med/tilgang til behandling med interstitiell teknikk henviser til avdeling med slik kompetanse ved behov.
Fraksjonering
Brakybehandlingen med høydoserate gis vanligvis med 4–5 fraksjoner slik at de anbefalte summerte dosene oppgitt under oppnås. EQD2 dosene inkluderer 45 Gy/25 fraksjoner som er gitt ved ekstern strålebehandling.
Det anbefales maksimalt 3 fraksjoner med brakyterapi per uke. Ved 3 fraksjoner på en uke forutsettes at ekstern strålebehandling er avsluttet.
I EMBRACE 1 studien ga en median dose på 90 Gy til D90 av CTV HR en 5-års lokal kontrollrate på 92%* (Pötter et al., 2021). EMBRACE 2 studien har følgende dosekrav (totaldose med ekstern stråledose og dose fra brakyterapi):
Målvolum: | Dosevolum krav EQD2 (α/β=10 | Dosevolum ønsker EQD2 (α/β=10 |
|---|---|---|
GTV | D98 > 90 Gy | D98 > 95 Gy |
CTV_HR | D90 > 85 Gy | 95 Gy < D90 > 90 Gy D98 > 75 Gy |
Punkter: |
|
|
Punkt A |
| > 65 Gy (kun aktuelt ved intracavitær behandling) |
Toleransedoser
Organ | Dosevolumkrav D2ccm (EQD2 (α/β=3)) | Dosevolumønsker D2ccm D2ccm (EQD2 (α/β=3)) |
|---|---|---|
Bladder | < 90 Gy | < 80 Gy |
Rectum | < 75 Gy | < 65 Gy |
Sigmoid | < 75 Gy | < 70 Gy |
Bowel | < 75 Gy | < 70 Gy |
Det er et ønske å redusere dosen til øvre vagina hvis mulig. Vaginalpunktene kan brukes til dette. Vurdering av 200 %-isodosen rundt vaginalapplikatoren er også nyttig. Ved å redusere dosen i vaginalapplikatorenog øke dosen i sonden og eventuelle nåler kan dose til vagina reduseresuten å redusere dosen til målvolumene (Mohamed et al., 2016).
| Ønsker | Prioritet |
|---|---|---|
ICRU recto-vaginal punkt dose | < 65 Gy (EQD2α/β=3 ekstern + braky) | Primær |
Konkomitant kjemoterapi
Bedre resultater av strålebehandling kombinert med cellegift sammenlignet med strålebehandling alene ble demonstrert i en meta-analyse fra 2001 og senere i en Cochrane review fra 2010 (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Green et al., 2001). Standard behandling ved lokalavansert livmorhalskreft i dag er derfor strålebehandling i kombinasjon med cellegift.
Det anbefales at cisplatin som hovedregel gis mandag, tirsdag eller onsdag, men kan unntaksvis gis på en torsdag for så å fremskynde uken etter. Minimum 5 dager mellom 2 på følgende kurer.
Cisplatin bør tilstrebes å ha blitt ferdig infundert før pasienten får sin daglige strålebehandling.
Ukentlig Cisplatin (40 mg/m2) gitt konkomitant med ekstern strålebehandling er det foretrukne regimet da studier med andre medikamenter eller kombinasjoner til nå ikke har vist å gi bedre resultater, men har medført økt toksisitet (Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC), 2010; Chen et al., 2017; Deng et al., 2022; Mohamed et al., 2016). Man har i EMBRACE I sett flere residiver når mindre enn 5 kurer er gitt (Schmid et al., 2014). Det tilstrebes derfor at det gis 5–6 kurer totalt. De fleste studier og retningslinjer opererer med en maksimal dose med Cisplatin på 70 mg.
Individuell vurdering, men veiledende grenser på ≥ 1-x 109/L for neutrofile og TPK > 75 x109/L for å gi kur. Veiledende grense estimert GFR > 50.
Man bør redusere Cisplatindosen til 30 mg/m2 ved mer enn en kurutsettelse grunnet for lave hematologiske verdier, eller etter en episode med febril neutropeni.
En bør avstå fra konkomitant kjemoterapi framfor å risikere å avbryte strålebehandlingen hos pasienter med redusert toleranse på grunn av nedsatt allmenntilstand eller komorbiditet.
Ukentlig Cisplatin må regnes som et høyemetogent kur-regime, særlig pga kombinasjon med abdominal bestråling. Det anbefales derfor at det gis et antiemetisk regime i tråd med de til enhver tids gjeldende anbefalinger for slike kur-regimer (Einhorn et al., 2017).
Dersom cisplatin er kontraindisert kan ukentlig Karboplatin (AUC2) være et alternativ, selv om man har begrenset med data som viser effekt i denne settingen (Cetina et al., 2008; Dubay et al., 2004; Katanyoo et al., 2011; Nam et al., 2013; Tharavichitkul et al., 2016)
Postoperativ radiokjemoterapi
Overlevelsen etter radikal kirurgi uten adjuvant behandling for cervixcancer i tidlig stadium er god med ca. 90 % 5-års overlevelse (Larsen, 2015). Ved hjelp av histopatologiske prognostiske faktorer kan man velge ut pasienter som kan ha nytte av adjuvant behandling og dermed bedre prognosen.
Postoperativ strålebehandling har i flere studier vist signifikant redusert residivfrekvens ved tidlig cervixcancer med risikofaktorer (L. Rogers, Siu, Luesley, Bryant, & Dickinson, 2012; Rotman et al., 2006; Sedlis et al., 1999; Van de Putte et al., 2005).
Konkomitant kjemoterapi (Cisplatin) anbefales.
Indikasjon:
I tråd med ESGO-guidelines (Cibula et al., 2018b) er adjuvant radiokjemoomterapi indisert i høyrisikogruppen, dvs dersom minst en av følgende kriterier foreligger:
- Lymfeknutemetastaser i bekkenet. Gjelder makrometastaser pN1 eller mikrometastaser pN1 (mi).
- Parametrieinfiltrasjon
- Ufrie kirurgiske marginer (Estape et al., 1998; Khanna et al., 2016; McCann et al., 2013; Viswanathan et al., 2006)
- Adjuvant behandling kan i tillegg vurderes ved funn av isolerte tumorceller i sentinel LNs, selv om klinisk betydning er usikker.
- Adjuvant radiokjemoterapi kan vurderes i intermediær risikogruppe (kombinasjon av risikofaktorer basert på endelig histologi; tumorstørrelse, invasjon i kar/lymfebaner og dybde på stromainvasjon. Adjuvant radiokjemoterapi kan i denne gruppen vurderes på bagrunn av Sedlis kriterier:
Postoperativ strålebehandling (+/- konkomitant cisplatin) på bakgrunn av andre risikofaktorer* for tilbakefall vurderes i MDT møter i de enkelte kasus.
Invasjon i kar/lymfebaner | Dybde på stromainvasjon | Tumorstørrelse |
|---|---|---|
Ja | Ytre 1/3 | Alle |
Ja | Midtre 1/3 | >= 2 cm |
Ja | Indre 1/3 | >= 5 cm |
Nei | Midtre eller ytre | >= 4 cm |
Anbefalinger for adjuvant radiokjemoterapi i intermediærgruppen er basert på to gamle prospektive studer fra 1999 (Sedlis et al., 1999) og 2000 (Peters et al., 2000). Det har nylig blitt publisert en reviewartikkel i Int J Gynecol Cancer (Rodriguez et al., 2022) hvor forfatterne stiller spørsmål om det er på tide å oppdatere anbefalingene for adjuvant behandling etter radikal kirurgi ved cervix cancer i intermediær risikogruppe. GOG92, med sine begrensninger, er den eneste studien med evidens som støtter adjuvant behandling i intermediær risikogruppen. Det har vært en formidabel forbedring i billeddiagnostikk, patologi, staging og behandling (både kirurgi og strålebehandling) i løpet av de siste årene. På bagrunn av det er det mulig at flere i intermediærgruppen blir overbehandlet. Foreløpig foreligger det ikke evidens for at man bør utelate adjuvant behandling i denne gruppen. Rodrigez et al konkluderer med at inntil ny evidens blir publisert, bør vi forsette å individualisere behandlingen i intermediær risikogruppen (Rodriguez et al., 2022).
Oppstart postoperativ strålebehandling anbefales 4–8 uker etter operasjon.
Fiksering/pasientleie/Bildeopptak for 3D-planlegging/Inntegning av risikoorgan:
Se avsnitt "Ekstern strålebehandling, Forberedelser" og "Brakyterapi, Bildeopptak for 3D-planlegging" over.
Inntegning av målvolumer:
Internasjonale konsensus dokumenter for inntegning av målvolum for postoperativ radioterapi (Small et al., 2008; Toita et al., 2010).
Clinical Target Volume (CTV), Klinisk målvolum:
CTVe:
- Øvre begrensning av CTVe bør ligge et snitt under aortabifurkaturen.
- Nedre begrensning av CTVe bør ligge minst 2 cm kaudalt for vaginaltoppen eller 1 cm kranialt for foramen obturatorius nedre begrensning.
- Følgende strukturer bør inkluderes i CTV:
- Lymfeknutestasjoner ved iliaca communis, iliaca externa, iliaca interna og presakralt.
- Eventuelle lymfoceler
- Øvre vagina, minst 2 cm, samt paravaginalt bløtvev lateralt for vagina
- Parametrier
CTVn:
Gjenstående patologiske lymfeknuter defineres som CTVn.
ITVe
Det anbefales å bruke individualiserte ITV marginer. Caudale del av CTV som ligger mellom rektum og blære, vil ha behov for ITV-margin (spesielt i anterior/posterior retning avhengig av rektumfylning).
I praksis er det anbefalt å starte med standard marginer og tilpasse volumet individuelt for hver pasient basert på bevegelsesinformasjon fra bildegrunnlagene (CT/MR).
Planning Target Volume (PTV):
se avsnitt "Inntegning av volumer" over.
Fraksjonering:
- Ekstern strålebehandling opp til minst 45 Gy (EQD2). 1,8–2 Gy per fraksjon. 5 fraksjoner pr uke.
- Evt. boost (ekstern eller braky) ved ufri eller knapp margin. Vanligvis vil det gis en summert dose på 60 Gy (EQD2α/β=10). Ved ekstern teknikk kan SIB med fordel benyttes.
- Evt. CTVn boostes til samme dosenivå som gjelder for primær radiokjemoterapi (se avsnitt "Fraksjonering" over).
Strålebehandlingsteknikker: Se "Strålebehandlingsteknikker ved brakyterapi" over.
Beregningsalgoritmer og energi: Se "beregningsalgoritmer og energi under "radikal radiokjemoterapi ved lokoregional sykdom".
Akutte bivirkninger under stråleterapi
Strålebehandling mot bekkenet gir ofte bivirkninger. Grad er avhengig av dose, fraksjonering og volum samt komorbiditet og livsstil, for eksempel røyking (Eifel et al., 2002). Pasienter med bindevevssykdom, inflammatorisk tarmsykdom og karsykdom har høyere risiko for bivirkninger (Willett et al., 2000; Wo et al., 2007). I tillegg er det stor individuell variasjon i toleranse.
Cisplatin i kombinasjon med bekkenbestråling øker risikoen for bivirkninger (Keys et al., 1999).
Akutte strålebivirkninger oppstår underveis eller kort tid (opptil 4 uker) etter strålebehandlingen.
Akutte strålebivirkninger bør graderes ved hjelp av Common Terminology Criteria for Adverse Events (CTCAE) (U.S. Department of Health and Human Services, 2017). Denne graderingen kan være til hjelp for å iverksette tiltak.
Organer som ofte blir affisert ved strålebehandling mot bekkenet:
Urinveier:
Akutt strålecystitt som skyldes inflammasjon og ødem i blæreslimhinnen, ses hyppig (Viswanathan et al., 2010). Gir dysuri, hyppig vannlating, urge, nocturi og blærespasme. Det er viktig å utelukke urinveisinfeksjon.
Spontan bedring inntrer oftest 1 -2 uker etter fullført strålebehandling. Antiflogistika kan brukes ved plagsom dysuri.
Gastrointestinaltraktus:
Tarmen er svært sensitiv for strålebehandling. Hyppige bivirkninger er kvalme og oppkast. Symptomer på skade av tarmslimhinnen inkluderer kolikksmerter, diare, anorexi, rektumsmerter, blod/slim i avføringen og tenesmus.
Det viktigste er symptomlindrende behandling, rikelig væskeinntak, kostråd, antiemetika og eventuelt Loperamid (Muehlbauer et al., 2009). Enkelte pasienter får såpass uttalte bivirkninger at de får behov for intravenøs væske (og eventuelt elektrolyttilskudd) og parenteral ernæring.
Ovarier:
Ovariene er svært strålesensitive. Sensiviteten er aldersavhenig (økt ved høy alder) (Bisharah et al., 2003; Morice et al., 1998; Panay et al., 2009).
Strålebehandling av ovariene medfører prematur menopause og infertilitet. Symptomer på menopause kan være for eksempel hetetokter, søvnforstyrrelser, urinveisplager, tørre slimhinner, nedsatt libido, muskel/leddplager, nedstemthet og depressive symptomer. I tillegg økt risiko for osteoporose, hjertekarsykdom, utvikling av demens og Parkinsonisme. Den økte risikoen er mest uttalt for de yngste pasientene. Klimakteriet før fylte 40 år er forbundet med redusert levealder.
Beinmarg:
Hematopoietiske celler er strålesensitive. Cirka 25 % av beinmargsreservene er lokalisert i bekkenet. Hematologisk toksisitet kan reduseres ved bruk av IMRT (Hui et al., 2014).
Hud/slimhinner:
Akutt hudreaksjon varierer fra erytem til våt deskvamasjon og sjeldent ulserasjon. Moderne strålebehandling er hudbesparende.
De fleste pasientene får kun milde hudbivirkninger ved strålebehandling av cervixcancer. Pasienter som får lyskefelt er mer utsatt for akutte hudbivirkninger.
God hygiene, lufting av området, unngå tettsittende klær og parfymerte produkter. Vulvaskylling kan forebygge sårhet og infeksjoner. For øvrig vises det til hvert enkelt strålesenters lokale prosedyrer.
Dermatitten kan forverres de første par ukene etter avsluttet behandling.
Oppfølging av akutte strålebivirkninger underveis i behandlingsløpet:
Det anbefales ukentlige strålekontroller hos lege/sykepleier underveis i strålebehandlingen. Det må da være fokus på akutte bivirkninger fra blære, tarm, vagina, hud samt beinmarg med blodprøvekontroll (Hb, leukocytter, neutrofile granulocytter og trombocytter).
Neoadjuvant og adjuvant kjemoterapi
Neoadjuvant kjemoterapi før kirurgi
Endelige og preliminære resultater fra randomiserte fase III studier støtter norsk praksis om å ikke bruke neoadjuvant kjemoterapi etterfulgt av kirurgi som alternativ til radiokjemoterapi. Flere randomiserte studier har blitt piblisert etter enCochrane review i 2012. Samlet viste studiene ingen gevinst i overlevelse, men an høy andel med pasienter som ble behandlet med postoperatic strålebehandling etter NCT og kirurgi (Gupta et al., 2018; Kenter et al., 2019; Rydzewska et al., 2012; Tangjitgamol et al., 2019).
I spesielle tilfeller (f.eks. fertilitetsbevarende kirurgi, graviditet og ved kontraindikasjoner for strålebehandling) kan NACT likevel vurderes. Individuelt tilpasset opplegg anbefales da. Viser til eget avsnitt .
Neoadjuvant kjemoterapi før radikal radiokjemoterapi
For neoadjuvant kjemoterapi før strålebehandling må man avvente nye studier før dette kan anbefales (da Costa et al., 2019; Wang et al., 2021). Kan likevel vurderes på enkeltpasienter med særdeles lokalavanserte svulster hvor det er spesielt høy risiko for fjernmetastaser utenfor strålefeltet og brakyterapi-dekning fordrer en optimal lokal respons (Kitagawa et al., 2015).
Det anbefales da 3 kurer med taxan-cisplatin kombinasjon, 3 ukers intervall. Bevacizumab er ikke anbefalt i denne settingen så lenge intensjonen med NACT er å gi strålebehandling. Om man ved evaluering ikke ser indikasjon for strålebehandling, bør man vurdere å behandle pasienten i tråd med regime beskrevet under «Medikamentell behandling ved metastatisk sykdom. Viser til avsnitt om medikamentell behandling for indikasjon for bevacizumab. Evaluering med CT/MR. Oftest bør man unngå flere kurer før strålebehandling, selv med god respons (Davis et al., 2000). Cisplatin kan fortsatt gis konkomitant med strålebehandlingen etterpå.
Det pågår en randomisert internasjonal multisenter studie (INTERLACE studien), NCT01566240 (Induction Chemotherapy Plus Chemoradiation as First Line Treatment for Locally Advanced Cervical Cancer (INTERLACE) [pågående studie], 2012-2026), for pasienter med FIGO stadium IB2-IVA med 6 ukentlige kurer Paclitaxel/Carboplatin etterfulgt av standard radikal radiokjemoterapi versus standard radikal radiokjemoterapi. Inklusjonsmål (500 pas) forventes nådd i 2022 og resultater få år etter dette.
Adjuvant kjemoterapi etter radiokjemoterapi:
Det er så langt ikke vist klar nytteverdi av adjuvant kjemoterapi etter gjennomført kjemoradioterapi. Flere studier har vist sprikende resultater og med svakheter knyttet til design, rekruttering og økt toksisitet (Dueñas-González et al., 2011; Tangjitgamol et al., 2019). Flere oversiktsartikler som vurderte adjuvant kjemoterapi etter konkomitant kjemoradioterapi ved lokalavansert cervixcancer, konkluderte med at det ikke var evidens for å støtte adjuvant kjemoterapi- analyser (Horeweg et al., 2022; Tangjitgamol et al., 2014; Zhong et al., 2022). En randomisert fase III studie i regi av ANZGOG (Cisplatin and Radiation Therapy With or Without Carboplatin and Paclitaxel in Patients With Locally Advanced Cervical Cancer [pågående studie], 2012-2018), for pasienter med stad IB1 med lymfeknutemetastaser og IB2-IVA, sammenlignet 10–25 % av cervixcancer er adenokarsinomer, disse skal graderes. De fleste er av konvensjonell eller endometroid type, disse er HPV assosiert. Det finnes noen sjeldne subtyper av adenokarsinomer som ikke er assosiert med HPV; adenokarsinom av gastrisk type, klarcellet type og mesonefrisk type (Park, 2020) etterfulgt av 4 kurer med paclitaxel og karboplatin med standard kjemoradioterapi. Resultatene ble publisert i abstrakt-form i 2021 (Mileshkin et al., 2021) og viste ingen benefit av adjuvant kjemoterapi på overlevelse eller lokal kontroll, kun økt toksisitet.
Videre forskning på adjuvant behandling vil avklare nytteverdi på subgrupper som for eksempel adenocarcinom (Tang et al., 2012), persisterende HPV-DNA (Wang et al., 2019). Bruk av konkomitant og eller adjuvant bruk av sjekkpunkthemmer undersøkes også i aktuelle studier (Garcia-Duran et al., 2022; Mayadev et al., 2020; Nivolumab in Association With Radiotherapy and Cisplatin in Locally Advanced Cervical Cancers Followed by Adjuvant Nivolumab for up to 6 Months (NiCOL) [pågående studie], 2017-2022; Study of Chemoradiotherapy With or Without Pembrolizumab (MK-3475) For The Treatment of Locally Advanced Cervical Cancer (MK-3475-A18/KEYNOTE-A18/ENGOT-cx11/GOG-3047) [pågående studie], 2020-2024)